南湖新闻网讯(通讯员 吴一超 付承霞)近日,我校农业微生物资源发掘与利用全国重点实验室、资源与环境学院黄巧云教授团队在Nature Communications期刊发表题为“Cooperative microbial interactions drive spatial segregation in porous environments”的研究论文。该研究利用自主构建的土壤微流控芯片结合多组学技术,揭示了微生物相互作用驱动孔隙环境中生物膜群落组装及其空间生态位分化机制,为理解自然生态系统中微生物群落多样性的形成与稳定过程提供了新见解。
土壤和沉积物等孔隙环境是地球上微生物的主要栖息地。在这些孔隙环境中,微生物通过分泌胞外聚合物相互粘结形成具有多细胞结构的生物膜。与浮游细胞相比,生物膜细胞具有更强的环境适应能力和独特的生态功能等涌现性特征。因此,揭示生物膜形成与功能发挥机制对于维护微生物生态系统、保障环境健康、支撑绿色发展至关重要。在生物膜形成过程中,微生物通过相互作用形成具有一定空间组织结构的生物膜群落,但微生物之间复杂的相互作用如何调控生物膜群落的组装和空间分布仍不清楚。
基于上述背景,团队自主构建了具有微柱阵列的土壤微流控芯片,解析了孔隙环境中土壤生物膜群落的组装过程。研究发现,孔隙环境中浮游微生物与生物膜之间的相互作用会促使微生物群落空间分化(图1)。通过耦合多组学表征技术,进一步证明了生物膜形成能力较弱的节杆菌(Arthrobacter)通过去除生物膜形成抑制分子D型氨基酸,促进假单胞菌(Pseudomonas)在固相表面定殖形成生物膜(图1b)。同时,生物膜在形成过程中分泌的公共代谢产物,则会提高节杆菌在流体环境中的生长与繁殖。这种互惠型合作关系促使节杆菌与假单胞菌能够在群落定殖初期分别快速占据流体环境和固相表面,进而诱导孔隙环境中微生物群落的空间组装与分布(图1)。上述研究结果为土壤和沉积物等孔隙环境中微生物群落的组装和演替提供了新的见解。
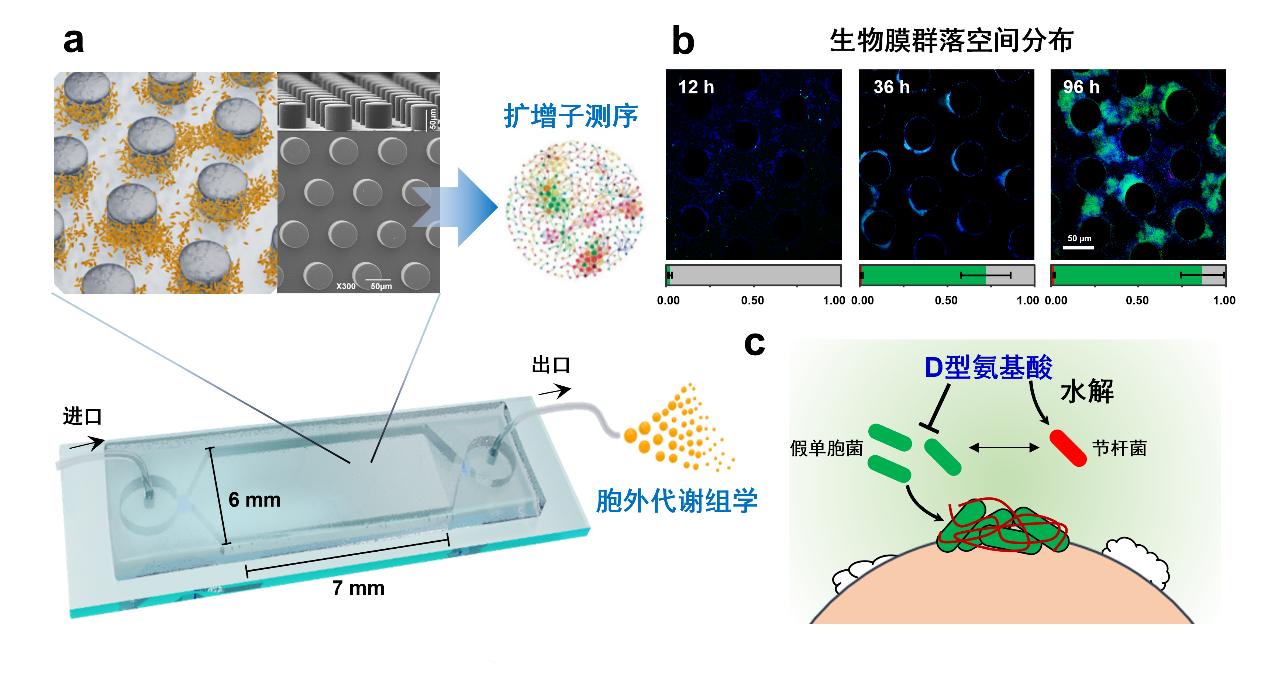
图1. 微生物互作驱动孔隙环境中生物膜群落组装及其空间生态位分化
华中农业大学资源与环境学院吴一超副研究员和博士研究生付承霞为论文共同第一作者,蔡鹏教授为论文通讯作者。华中农业大学黄巧云教授、高春辉副研究员、刘俊研究员、英国利兹大学Caroline L. Peacock教授、丹麦哥本哈根大学Søren J. Sørensen教授、英国皇家园艺学会Marc A. Redmile-Gordon研究员、中国科学院生态环境研究中心朱永官研究员、肖可青研究员、华中科技大学宋培义副教授、美国俄克拉荷马大学周集中教授等参与了本项研究工作。该研究得到了国家重点研发计划、国家杰出青年科学基金、中央高校基本科研业务费专项资金等项目资助。
【英文摘要】
The role of microbial interactions and the underlying mechanisms that shape complex biofilm communities are poorly understood. Here we employ a microfluidic chip to represent porous subsurface environments and show that cooperative microbial interactions between free-living and biofilm-forming bacteria trigger active spatial segregation to promote their respective dominance in segregated microhabitats. During initial colonization, free-living and biofilm-forming microbes are segregated from the mixed planktonic inoculum to occupy the ambient fluid and grain surface. Contrary to spatial exclusion through competition, the active spatial segregation is induced by cooperative interactions which improves the fitness of both biofilm and planktonic populations. We further show that free-living Arthrobacter induces the surface colonization by scavenging the biofilm inhibitor, D-amino acids and receives benefits from the public goods secreted by the biofilm-forming strains. Collectively, our results reveal how cooperative microbial interactions may contribute to microbial coexistence in segregated microhabitats and drive subsurface biofilm community succession.
论文链接:https://www.nature.com/articles/s41467-023-39991-4
审核人:蔡鹏