南湖新闻网讯(通讯员 李新风 陈芳)近日,我校生命科学技术学院/农业微生物学国家重点实验室何进教授课题组在eLife上发表了题为“Clp protease and antisense RNA jointly regulate the global regulator CarD to mediate mycobacterial starvation response”的研究论文。该研究从全局性转录因子CarD入手,发现细菌在饥饿条件下从翻译层面和翻译后层面严格控制着CarD蛋白的水平,通过降低细菌的转录、翻译和代谢速率,来抵御饥饿压力。
结核病是世界第一大传染病,距今已有五千多年的历史。全球约三分之一的人体内携带结核病的病原菌——结核分枝杆菌,每年约1000万人转为活动性结核病,并且每年约150万人因结核病而死亡。结核病难以防治的一个主要原因是其病原菌在宿主压力环境下(比如营养饥饿、缺氧等)通常进入休眠状态,这赋予了结核分枝杆菌极强的抗逆性,使宿主细胞无法将其彻底清除。因此,探索分枝杆菌的饥饿响应机制,有助于阐明其休眠机理,为结核病的防治提供新的思路。
转录是细胞中非常重要的生理过程,该过程由RNA聚合酶主导。与大多数细菌不同,分枝杆菌中的RNA聚合酶自身几乎没有转录活性,其转录活性依赖于两个全局性转录因子CarD和RbpA的协同激活。CarD/RbpA与RNA聚合酶直接相互作用,通过增强转录起始复合物的稳定性来提高转录活性。其中,CarD调控着分枝杆菌中三分之二基因的表达(包括rRNA基因),对于分枝杆菌的生长和生存至关重要,然而,CarD自身受到的调控目前还不清楚。
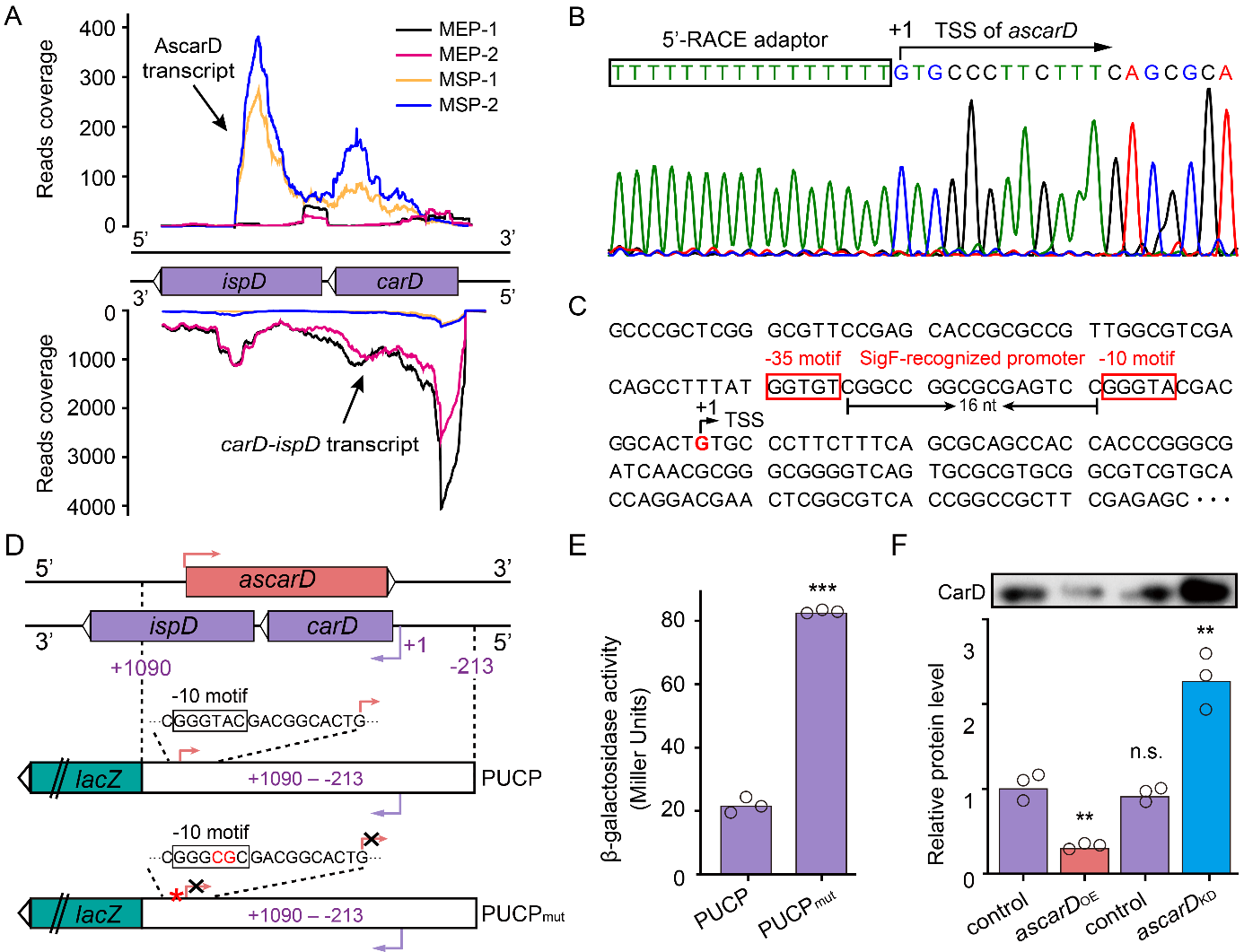
图1:AscarD在饥饿条件下抑制CarD的翻译
研究者在不同压力条件下分别测定了CarD的转录水平和蛋白水平,奇怪的是,CarD蛋白水平在饥饿条件下显著降低,但其转录本水平不降反升。这引起了研究者的兴趣。经过七年不懈努力,最终揭示了其中的奥秘。研究者发现,当分枝杆菌细胞从富营养状态转变到贫营养状态时,全局转录因子CarD在翻译水平和翻译后水平受到严格地调控。
首先,在翻译水平上:研究者首次发现carD存在反义RNA (anti-sense RNA)介导的顺式调控机制:即发现carD的反义链编码一个非编码RNA (将其命名为AscarD (Anti-sense carD)),AscarD受到σ因子SigF的调控,在稳定期和饥饿条件下特异性地表达,诱导表达的AscarD可与carD mRNA结合,影响了后者与核糖体的结合,抑制其翻译(图1)。另外,其结合能稳定carD转录本,使其产生“不降反升”的表型。
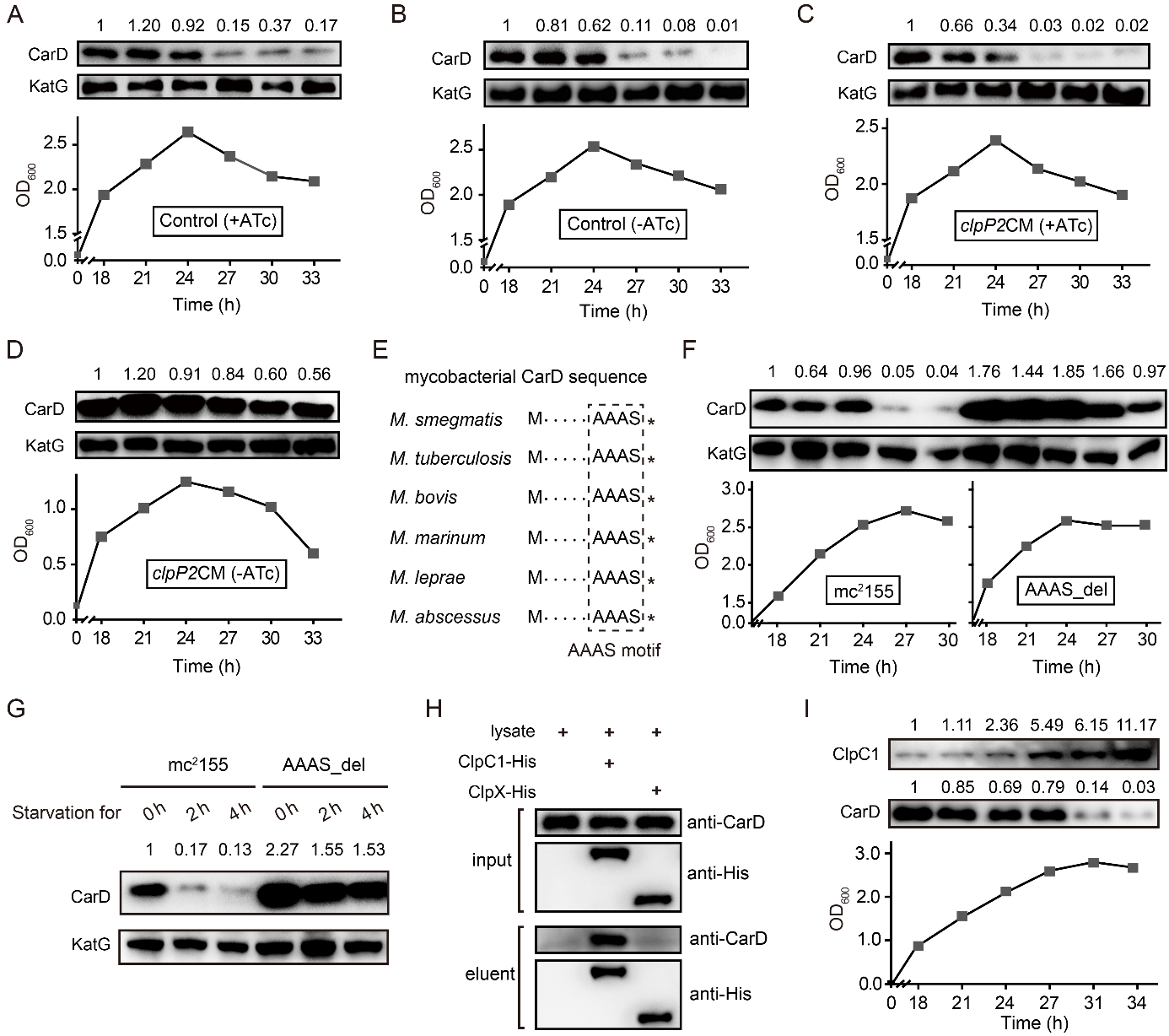
图2:Clp蛋白酶负责饥饿条件下CarD的高效降解
其次,在翻译后水平上,Clp蛋白酶复合体能高效识别并降解CarD。研究者发现,Clp蛋白酶通过识别CarD羧基端的保守motif“LAAAS”对其进行降解。敲除该motif阻断了Clp蛋白酶对CarD的降解,使细菌在稳定期/饥饿条件下仍保留较高水平的CarD。此外,蛋白酶复合物的去折叠亚基ClpC1在稳定期/饥饿条件下显著增加,这一方面促进了Clp活性复合物的组装,另一方面帮助了蛋白酶对CarD的识别,最终介导CarD的高效降解(图2)。
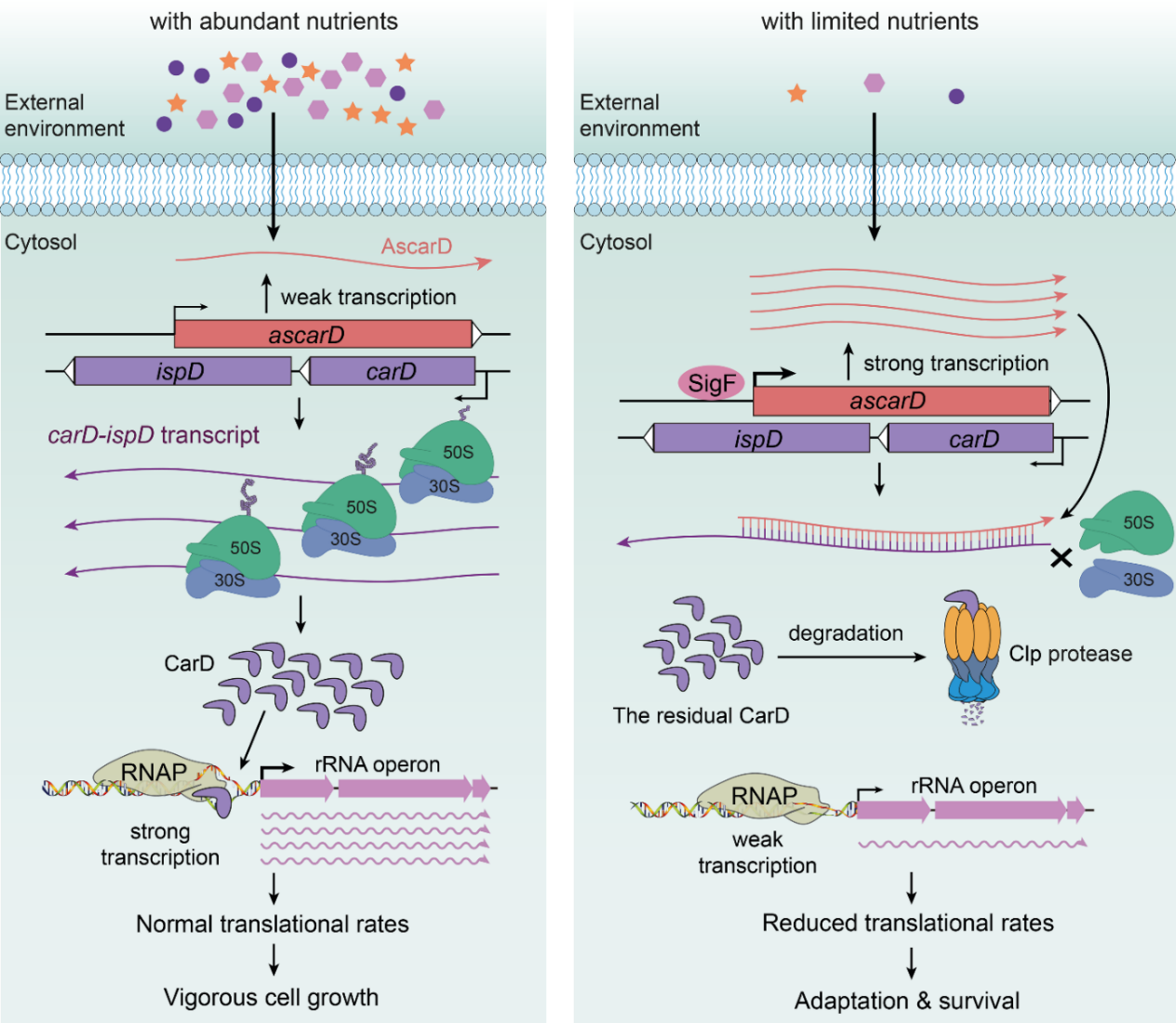
图3 反义RNA和Clp蛋白酶共同调节CarD介导分枝杆菌饥饿响应
总之,AscarD与Clp蛋白酶协同作用,从不同层面降低CarD的蛋白水平,以减缓分枝杆菌细胞的转录和翻译速度,最终帮助分枝杆菌细胞应对营养胁迫(图3)。该研究不仅拓展了我们对全局性转录调控因子CarD的认识,而且有助于我们更好地了解分枝杆菌在宿主环境中的适应、生存与休眠机制,为结核病的防治提供了新的思路。
博士后李新风和博士研究生陈芳并列为本文的第一作者,生命科学技术学院、农业微生物学国家重点实验室何进教授为通讯作者。台湾中兴大学教授/我校兼职教授周三和教授以及美国国立卫生研究院Michael Y. Galperin研究员参与了该研究。本研究得到了国家自然科学基金以及中国博士后科学基金的支持。
【英文摘要】
Under starvation conditions, bacteria tend to slow down their translation rate by reducing rRNA synthesis, but the way they accomplish that may vary in different bacteria. In Mycobacterium species, transcription of rRNA is activated by the RNA polymerase (RNAP) accessory transcription factor CarD, which interacts directly with RNAP to stabilize the RNAP-promoter open complex formed on rRNA genes. The functions of CarD have been extensively studied, but the mechanisms that control its expression remain obscure. Here, we report that the level of CarD was tightly regulated when mycobacterial cells switched from nutrient-rich to nutrient-deprived conditions. At the translational level, an antisense RNA of carD (AscarD) was induced in a SigF-dependent manner to bind with carD mRNA and inhibit CarD translation, while at the post-translational level, the residual intracellular CarD was quickly degraded by the Clp protease. AscarD thus worked synergistically with Clp protease to decrease the CarD level to help mycobacterial cells cope with the nutritional stress. Altogether, our work elucidates the regulation mode of CarD and delineates a new mechanism for the mycobacterial starvation response, which is important for the adaptation and persistence of mycobacterial pathogens in the host environment.
论文链接:https://elifesciences.org/articles/73347
审核人:何进
