11月17日,我校金双侠教授课题组和吉林大学李占军教授课题组联合在国际知名学术期刊Genome Biology在线发表题为“Double-stranded DNA deaminase DddAᴱ¹³⁴⁷ᴬ can increase the efficiency and targeting range of cytidine base editors”的研究论文,通过融合双链DNA脱氨酶DddAᴱ¹³⁴⁷ᴬ,成功开发出新型高效胞嘧啶碱基编辑器DMCBEs,显著提升了编辑效率与靶向范围,为动植物育种提供了全新工具。

DddAtox是来自伯克霍尔德菌(Burkholderia cenocepacia)的细菌间毒素DddA的酶活性组分,可催化双链DNA(dsDNA)中的胞嘧啶脱氨反应。研究表明,由拆分的DddAtox、TALE阵列和尿嘧啶糖基化酶抑制剂(UGI)组成的DdCBEs系统,能够实现线粒体DNA中C-to-T碱基转换。此外,基于TALE的ABE通过将TALE DNA结合阵列与全长DddA变体或分裂型DddA与TadA8e整合,实现了线粒体中的A-to-G编辑。这些发现使研究人员推测DddA在结合或催化过程中可能瞬时解旋双链DNA,暴露出少数核苷酸。
本研究创新性地将双链 DNA 特异性胞嘧啶脱氨酶 DddAᴱ¹³⁴⁷ᴬ与 CBEs 单碱基编辑器融合,开发出新型编辑器DMCBEs。与传统BE4max相比,优化后的DddAᴱ¹³⁴⁷ᴬ-BE4max(DMBE4max)表现出惊人的编辑性能:在细胞系中编辑效率最高提升 93 倍,在C14、C15 位点编辑效率可达52%;编辑窗口从C4-C8扩展至C4-C15,实现了对 PAM 近端位点的高效编辑。
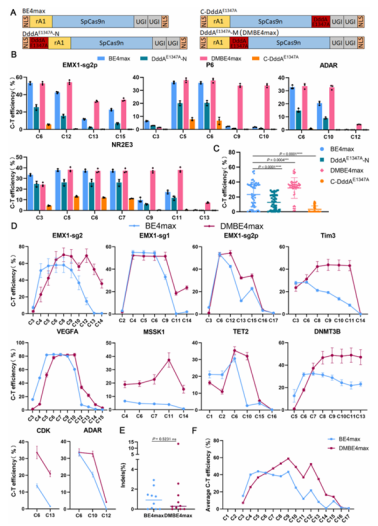
此外,该系统兼容性极强,可与多种 Cas9 变体(SpCas9、SpaCas9 等)及脱氨酶变体(A3A、A3G 等)适配,编辑效率都得到了进一步提高。
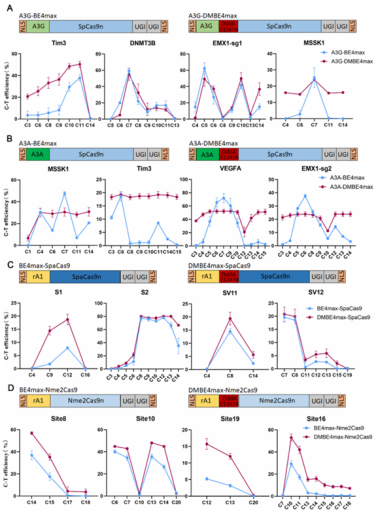
值得关注的是,通过结构预测,我们推测DddAᴱ¹³⁴⁷ᴬ并非直接发挥催化作用,而是通过诱导 Cas9 蛋白 REC2 结构域构象变化,增加双链DNA的可及性,为单链特异性脱氨酶提供更多底物,这一发现首次揭示了双链 DNA 脱氨酶从“催化酶”到“编辑增强子”的功能转变。
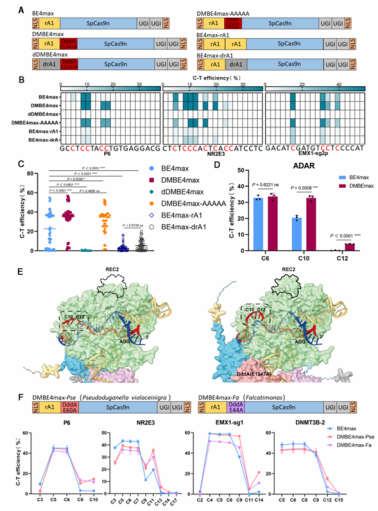
研究团队进一步在动物胚胎、烟草及棉花等不同体系中对 DMCBEs 进行了全面验证,展现出强大的应用潜力:在小鼠和兔胚胎中,DMBE4max对PAM近端位点的编辑效率达 8%-94%,而传统 BE4max在此类位点几乎无编辑活性;在烟草中,DMBE4max对NtPDS 基因的编辑效率最高达 84.78%,较 BE4max 提升 2.4 倍,且成功编辑了此前无法触及的 C1、C13 位点;在棉花愈伤组织中,针对 GhALS 基因的编辑效率提升了0.43-3.23倍,A3A-DMBE4max变体在 C13 位点的编辑效率达到 61.37%。
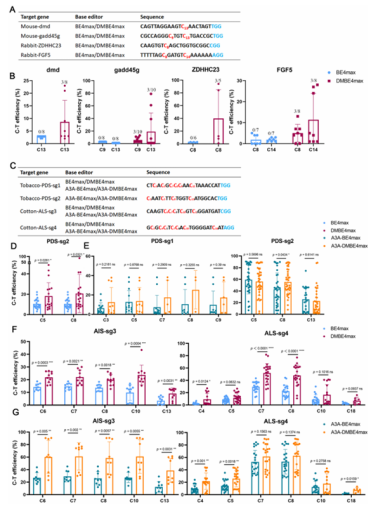
全基因组重测序与转录组测序证实,DMCBEs 在 DNA 和 RNA 水平均未产生额外脱靶效应,编辑特异性与传统工具相当,为其在生物育种中的安全性提供了保障。
吉林大学博士后钱育强和华中农业大学博士生惠凤娇为本论文共同第一作者,华中农业大学金双侠教授、吉林大学李占军教授和湖南中烟工业有限责任公司技术中心高军平博士为论文共同通讯作者。博士生牛文超、王迪、郝杨、孔德强,硕士生任思禹、龚恒、吴佳钰,孟庆营博士、Muna Alariq博士等参与了该项研究工作。本研究得到了华中农业大学生命科学技术学院殷平教授的重要指导,周晨博士、博士生黄灿、博士生熊仁毅、硕士生徐琳在蛋白表达纯化、结构预测等实验技术方面做出了重要贡献。该研究得到国家重点研发计划、国家杰出青年科学基金、湖北洪山实验室重大项目、中国博士后基金和湖南中烟工业有限责任公司科技项目资助。
论文链接:https://genomebiology.biomedcentral.com/articles/10.1186/s13059-025-03849-3
本文转自公众号:植物生物技术Pbj
原文链接:https://mp.weixin.qq.com/s/U-YyZklZEhWN3wANqr0SvA?scene=1&click_id=2