南湖新闻网讯(通讯员 康文尚)近日,我校农业微生物资源发掘与利用全国重点实验室、湖北洪山实验室、植物科学技术学院Kenichi Tsuda教授团队在国际知名学术期刊Current Biology发表题为“Evolutionary trade-off between stomatal defense and gas exchange in Brassicaceae”的研究论文。该研究揭示了植物病原细菌通过冠菌素(COR)调控拟南芥CYP707A1基因表达实现气孔重新开放的分子机制,并阐明了COI1-MYC2-CYP707A1信号模块在十字花科植物中的进化保守性与功能分化,为深入理解植物病原菌入侵策略和气孔调控机制提供了重要理论依据。
气孔是植物进行光合作用和蒸腾作用的关键结构,同时也是病原菌侵染的重要入口。植物病原细菌丁香假单胞Pseudomonas syringae分泌的COR可操控植物激素信号通路,导致原本关闭的气孔重新开放,但其精确调控机制尚不清楚。围绕这一科学问题,研究团队系统解析了COR如何影响气孔动态,以及植物如何在“防御”与“生长”之间实现平衡。
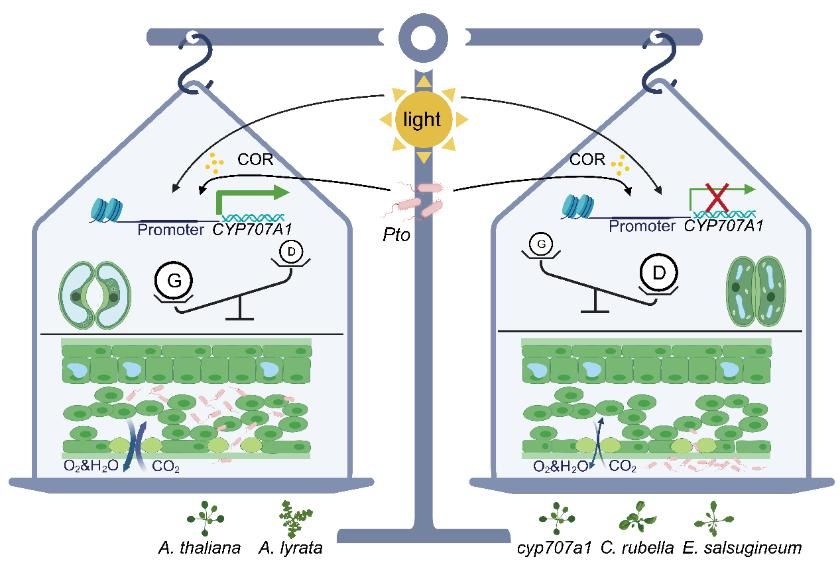
研究发现,COR 能够特异诱导拟南芥 CYP707A1 的表达,而同家族的其他基因并不响应。进一步的遗传和生理实验表明,COR激活CYP707A1依赖JA信号通路中的关键因子COI1与MYC2/3/4。在关键突变体(cyp707a1、coi1、myc234)中,COR无法逆转由flg22或ABA诱导的气孔闭合,而其他CYP707A突变体仍然有效,表明COI1-MYC2-CYP707A1是COR介导气孔重新开放的核心模块。研究团队还发现,CYP707A1调控光响应气孔开放。
在进化研究方面,团队比较了拟南芥近缘物种A. lyrata、C. rubella和E. salsugineum,发现不同物种对COR的响应存在显著差异。启动子互换实验显示,CYP707A1 启动子序列中的 G-box 及其类元件(G-box-like)是决定COR响应性的关键因素。其中G-box-like 1在超过780个拟南芥天然群体中高度保守,体现了该调控模块在维持气孔快速开放和光合作用效率方面的重要性。
研究最终提出,COI1-MYC2-CYP707A1模块同时参与病原菌感染时期的气孔操控和光照条件下的生理性气孔开放,体现了植物在“气孔防御”和“气体交换效率”之间的进化权衡。这一发现不仅深化了对植物气孔调控网络的认识,也为植物抗病育种提供了潜在的分子靶标。
华中农业大学植物科学技术学院植物免疫团队博士研究生康文尚、已出站博士后Masahito Nakano、德国马普植物育种所已毕业博士生Kaori Fukumoto和日本京都大学Rikako Hirata博士为论文共同第一作者,Kenichi Tsuda教授、韩晓伟教授和日本京都大学Akira Mine教授为共同通讯作者。洪坤奇、杜雨琳、Yayoi Tsuda、Dieter Becker等团队成员参与了本研究。德国莱布尼茨研究所Jörg Ziegler博士、加拿大多伦多大学Eiji Nambara教授、日本北海道大学Ryohei Thomas Nakano教授和奈良先端科学技术大学院大学Shunsuke Miyashima教授,以及本团队丁苗苗、陈新华等成员对研究工作提供了重要支持。该研究得到了国家自然科学基金、国家重点研发计划、中央高校基本科研业务费等项目资助。
审核人 Kenichi Tsuda 韩晓伟
论文链接:https://doi.org/10.1016/j.cub.2025.10.037
英文摘要:
Stomatal opening is crucial for gas exchange, but it unavoidably offers invasion by pathogens. In response, plants close stomata to prevent pathogen entry, while the bacterial pathogen Pseudomonas syringae pv. tomato DC3000 (Pto) produces coronatine (COR), a jasmonate (JA) mimic, to counteract this plant response. Here, we demonstrate that by COR, Pto exploits CYP707A1 activation in Arabidopsis thaliana, encoding an enzyme that degrades abscisic acid, essential for stomatal closure. Notably, COR-induction of CYP707A1 is absent in other Brassicaceae species, such as Capsella rubella and Eutrema salsugineum, rendering them resistant to Pto invasion. In contrast, in A. thaliana, CYP707A1 enables rapid stomatal opening in response to light in a JA-dependent manner, enhancing gas exchange and chlorophyll content, unlike C. rubella and E. salsugineum. Promoter-swap experiments confirm that the regulatory region of CYP707A1 underlies these evolutionary diversifications. Together, our study presents a mechanism underlying an evolutionary trade-off between stomatal defense and gas exchange.