南湖新闻网讯(通讯员 卜旭莹)近日,生命科学技术学院李英俊教授团队研究成果以“A novel two-component system regulates shikimate pathway for thermal adaptation in Thermus thermophilus”在Nucleic Acids Research发表。研究以极端嗜热菌Thermus thermophilus HB27为研究材料,使用内源性CRISPR编辑工具和系列生化实验,系统解析了HB27中一个响应低温的新型双组分系统——DhqSR。
温度刺激是地球上所有生命体必须面对的基本环境挑战,对工业微生物和农作物生长发育构成重要制约。因此,开展细胞工程改造,提升生物体对温度胁迫的耐受能力,是优化工业菌种性能和保障粮食作物可持续生产的重要策略。双组分信号转导系统作为广泛存在于生物体中的环境感知系统,可直接响应温度信号,其核心组分包括定位于细胞膜的组氨酸激酶和分布于胞质的应答调控蛋白。深入挖掘双组分系统的功能机制,并将其应用于细胞温度耐受性的精准调控,对于提升工程菌株的环境适应性及保障农业生产力具有重要意义。
研究团队以嗜热菌Thermus thermophilus HB27为研究对象,这种细菌最适生长温度为65℃,在50℃的低温下就会生长受阻。通过转录组分析,他们找到了9个表达受温度影响的组氨酸激酶基因。敲除这些基因后,只有一个命名为TtS(后改名为DhqS)的基因缺失株表现出明显的低温敏感表型——在50℃几乎不能生长,但在65℃和80℃生长正常。这表明DhqS是细菌适应温度变化的关键蛋白。进一步的蛋白结构域分析发现,DhqS的传感器结构域、跨膜结构域和GAF结构域共同构成了一个完整的温度感知模块。缺少其中任何一个部分,细菌的温度适应能力都会受损。通过生化实验,研究团队证实DhqS确实是一个典型的组氨酸激酶,其第327位的组氨酸是自磷酸化位点。但这个系统真正让人意外的地方在后头。
按照教科书知识,组氨酸激酶通常把磷酸基团传递给响应调控蛋白的天冬氨酸。然而,当研究团队寻找DhqS的搭档蛋白TtR(后改名为DhqR)的磷酸化位点时,他们发现了一个意想不到的结果。质谱分析显示,DhqR的磷酸化位点是第84位的酪氨酸,而不是预期的天冬氨酸。当把酪氨酸突变成丙氨酸后,DhqR完全不能被磷酸化,细菌也失去了低温适应能力;而当天冬氨酸突变成丙氨酸后,磷酸化不受影响,细菌仍然可以正常生长。
这是一个颠覆传统认知的发现——首次报道细菌双组分系统通过组氨酸-酪氨酸磷酸化传递信号。
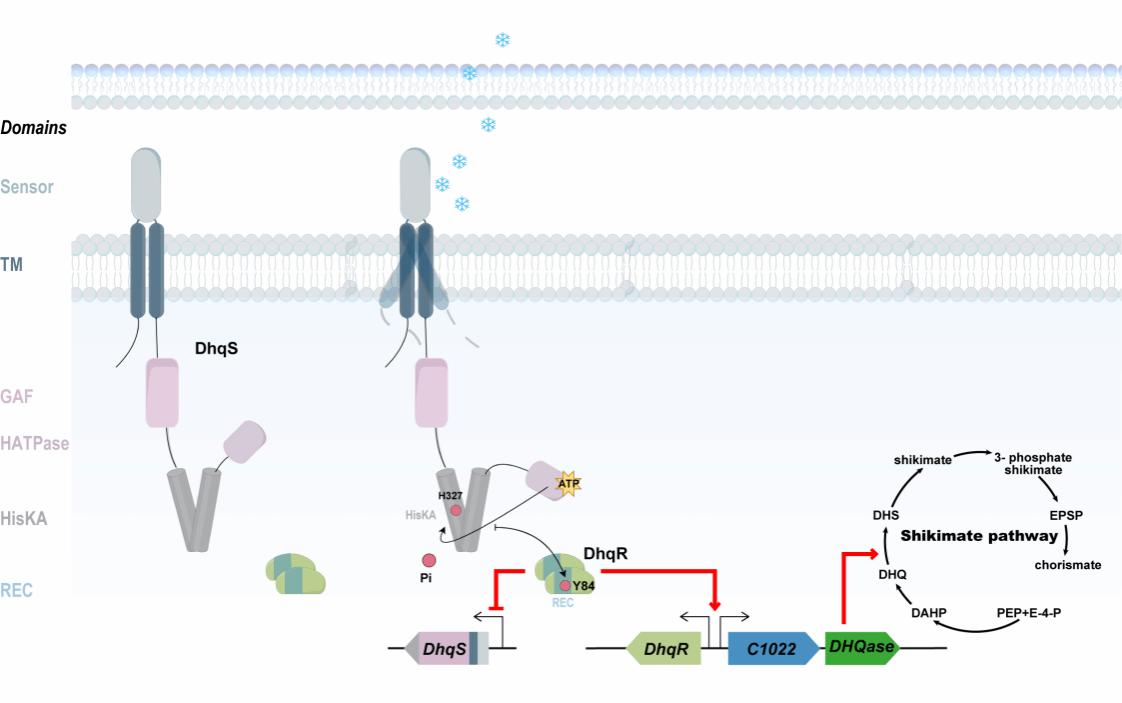
图1 DhqSR系统的调控策略
DhqSR双组分系统调控的下游基因是什么?通过DNA免疫沉淀测序,研究团队发现DhqR可以结合三个启动子区域:自身启动子、dhqS启动子,以及一个编号为HB27c_C1022基因的启动子。HB27c_C1022与下游的HB27c_C1023基因共转录。HB27c_C1023编码的蛋白是II型3-脱氢奎尼酸脱水酶,这是莽草酸途径的关键酶。莽草酸途径是合成芳香族氨基酸(苯丙氨酸、酪氨酸和色氨酸)的必经之路。在低温条件下,酶促反应速率会下降。嗜热菌通过上调莽草酸途径关键酶的表达,增加芳香族氨基酸的供应,从而保证蛋白质合成不受影响。这是一种非常聪明的适应策略(图1)。
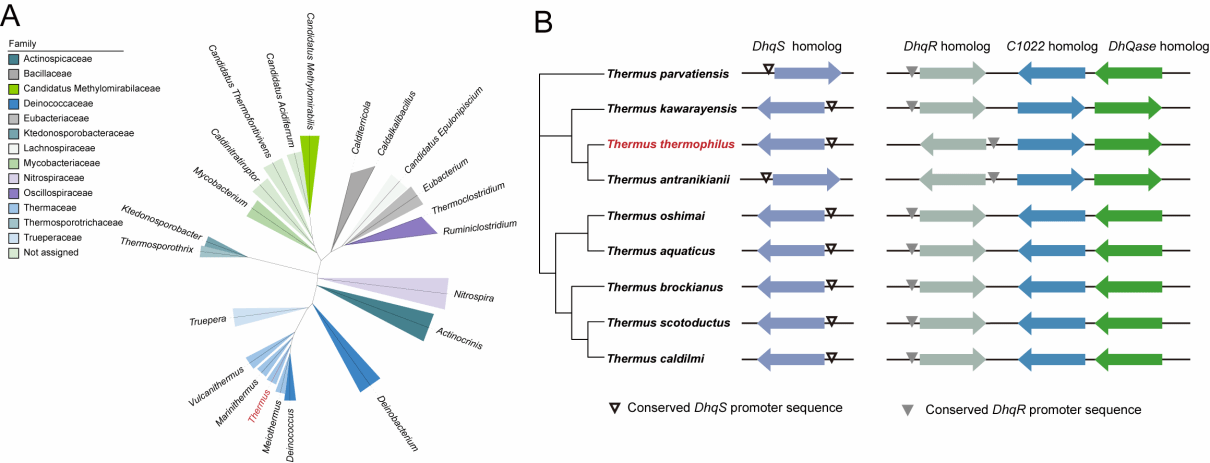
图2 DhqSR系统的进化关系
有趣的是,DhqSR系统并不是Thermus thermophilus HB27特有的。系统发育分析显示,含有DhqS、DhqR、HB27c_C1022和DHQase同源基因的物种分布在14个细菌科中,包括耐辐射奇球菌等极端环境微生物。特别是在Thermus属中,这种基因排列方式高度保守(图2)。这表明DhqSR系统可能是极端微生物应对环境胁迫的一个通用适应性模块。
综上所述,研究系统揭示了一种新颖的嗜热菌低温响应机制。DhqSR双组分系统的发现不仅为理解微生物环境适应提供了新视角,也为合成生物学和代谢工程提供了新的调控元件。
生命科学技术学院博士研究生卜旭莹为论文第一作者,李英俊教授为论文通讯作者。本研究得到了国家重点研发计划、国家自然科学基金等基金资助。
【英文摘要】
Temperature stress is a fundamental challenge for all organisms. While two-component systems (TCSs) are known to transduce environmental signals in microbes, their role in thermal sensing remains underex plored. Here, we unv eil a novel thermosensitive TCS, DhqSR, in the thermophile Thermus thermophilus HB27. We demonstrate that the histidine kinase DhqS perceives thermal cues and autophosphorylates at His327. Its cognate response regulator, DhqR, is activated through a unique tyrosine-phosphorylation mechanism: phosphorylation at a unique Tyr84 residue, rather than the canonical aspartate. This atypical DhqSR system orchestrates cellular thermoadaptation by directly regulating a key enzyme in the shikimate pathwa y , type II 3-dehydroquinate dehy d ratase (DHQase). Our ffndings reveal a novel molecular mechanism of temperature sensing and adaptation, providing a new paradigm for microbial environmental adaptation and offering a unique toolbox for engin eering thermotolerance.
论文链接: https://doi.org/10.1093/nar/gkaf116
审核人:李英俊