南湖新闻网讯(通讯员 黄兴喜)近日,我校生命科学技术学院、农业微生物资源发掘与利用全国重点实验室梁运祥教授团队在国际知名学术期刊Advanced Science在线发表了题为“Fermented Lacticaseibacillus Paracasei Cultures Ameliorate Colitis by Modulating Microbiota-Derived Tryptophan Metabolism and Macrophage Polarization”的研究论文。
炎症性肠病是21世纪消化系统疾病研究的重点与难点,其发病机制的高度复杂性、流行性的快速全球化趋势以及社会危害的多维性,肠道健康调节领域已成为亟需关注的公共健康问题。相比药物或手术治疗,安全、低成本的靶向肠道微生态学调控被认为更具临床转化潜力。
研究团队利用化学诱导的小鼠结肠炎模型,比较了活性培养物和热灭活后生元的效果。数据显示,两者都能改善体重减轻和结肠缩短等症状,但活性培养物疗效显著更优。它能近乎完全恢复受损的结肠隐窝结构,将炎症细胞浸润降至最低。
在机制层面,该培养物抑制了与炎症相关的变形菌门,同时显著提升了如毛螺菌科和乳杆菌属等有益菌的相对丰度。更重要的是,这种结构变化驱动了功能转变。代谢组学分析发现,培养物干预后,小鼠肠道内容物中的色氨酸代谢网络被彻底重构。特别是,肠道微生物来源的两种关键吲哚类代谢物——吲哚-3-乳酸(ILA)和吲哚-3-乙酸(IAA)的含量显著升高。培养物是通过富集微生物源性AhR配体来发挥疗效的。后续的粪菌移植实验和外源性补充ILA/IAA的实验,都再次验证了这条“菌群-代谢-免疫”轴的核心地位。此外,研究进一步在细胞模型中探索了ILA和IAA的直接免疫调节作用。结果显示,ILA/IAA通过抑制TLR4受体的表达及其下游的NF-κB和MAPK信号通路磷酸化,从而关闭了驱动M1极化的“开关”。这为理解益生菌代谢物如何精确调控肠道免疫提供了分子层面的证据。
这项研究描绘了一幅清晰的图景:高密度固态发酵制备的益生菌制剂是一个“多功能协同系统”。活性菌株负责生态位竞争与初步定植,发酵释放的基质活性成分(如黄酮)提供抗氧化支持,而菌群重构后内源产生的特定代谢物则精准调节宿主免疫。这种多层次、多靶点的协同作用,为开发新一代针对肠道微生态-免疫轴的疗法奠定了坚实基础。
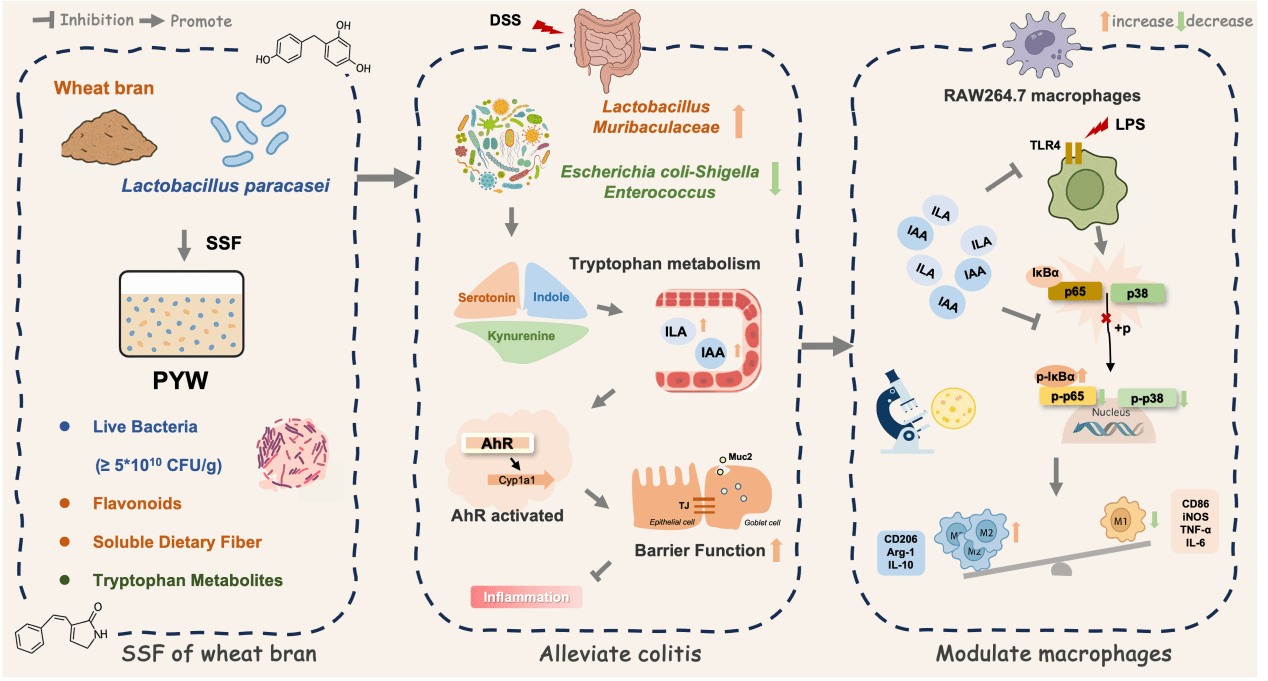
图1 培养物缓解结肠炎的机制图
华中农业大学生物工程流动站博士后张恒为论文第一作者,梁运祥教授和已出站博士后刘洋洋为本文的共同通讯。该研究获得了湖北省农业科技研究项目、湖北省自然科学基金和湖北省重点研发计划等项目的支持。
【英文摘要】
High-density solid-state fermented probiotic products, combining live bacteria with microbial and substrate-derived bioactives, offer a potential solution to address dysregulation of gut microbiota–immune homeostasis associated with inflammatory bowel disease (IBD). However, their synergistic efficacy against IBD remains elusive. Here, we discuss our high-density solid-state fermented Lacticaseibacillus paracasei culture (PYW) and its effects on dextran sulfate sodium (DSS)-induced colitis. Comparison of the effects of PYW, enriched with viable cells and bioactive metabolites—obtained via fermentation with wheat bran—with those of its thermally inactivated postbiotic (SPYW) shows superior efficacy of PYW than SPYW, with a viable bacterial load of ≥ 5 × 1010 CFU g−1 being indispensable. PYW effectively restores microbiota structure, restructures the gut tryptophan metabolic network, enriching indole-3-lactic acid (ILA) and indole-3-acetic acid (IAA), which activate the aryl hydrocarbon receptor (AhR) signaling pathway, suppress pro-inflammatory mediators, and strengthen mucosal barriers. Antibiotic depletion abolishes the effects of PYW, while fecal microbiota transplantation from PYW-treated donors and exogenous ILA/IAA supplementation replicate its anti-colitic benefits. These findings suggest that PYW alleviates colitis via microbiota-dependent enrichment of ILA/IAA and subsequent AhR pathway activation, highlighting its potential as a probiotic therapeutic targeting the microbiota–metabolism–immunity regulatory axis in IBD.
论文链接:https://doi.org/10.1002/advs.202513920
审批人:梁运祥