南湖新闻网讯(通讯员 郭孟悦)近日,我校生命科学技术学院、生物医学与健康学院陶伟伟团队与董志强团队联合在国际学术期刊Nature Communications上发表了题为 “USP10 promotes glioma stem cell maintenance and glioblastoma growth by antagonizing DTX3L-mediated SATB2 ubiquitination” 的研究论文。该研究发现去泛素化酶USP10通过拮抗E3泛素连接酶DTX3L对SATB2的泛素化修饰,阻断其被蛋白酶体降解,从而维持SATB2蛋白的稳定并促进GSCs的自我更新和GBM的生长。利用小分子抑制剂抑制USP10的活性可以显著抑制GSCs的功能和肿瘤生长,该研究将为GBM的精准防治提供潜在的药物靶点和干预策略。
胶质母细胞瘤(Glioblastoma, GBM)是成人中枢神经系统中恶性程度最高的肿瘤,被WHO分级为Ⅳ级(最高级)神经系统肿瘤。即使采取最大范围安全切除、同步放化疗,患者的中位生存期仍低于16个月。GBM 的难治性与其高度异质性密切相关,其组织中存在一小群具备持续自我更新与多向分化潜能的干细胞类群,被称之为胶质瘤干细胞(Glioma stem cells, GSCs)。 GSCs被视为GBM恶性生长的“细胞引擎”,在当前GBM治疗策略失败中扮演着核心角色。因此阐明其恶性自我更新的分子机制,并开发出靶向GSCs的新型干预手段,已成为突破GBM治疗瓶颈的重要手段。SATB2又叫特异AT序列结合蛋白2,是一种核基质蛋白。其主要作用是与DNA的核基质结合区相互作用从而调节染色质重塑和基因转录。该团队先前的研究发现,核基质蛋白SATB2在GSCs中高表达,是GSCs的特异性标志物。然而,GSCs中SATB2表达失调的分子机制尚不清楚。

在该研究中,研究人员通过免疫共沉淀结合质谱技术筛选到与SATB2相互作用的去泛素化酶USP10和E3泛素连接酶DTX3L。进一步的研究发现USP10和DTX3L两者都主要定位于GBM肿瘤内的GSCs亚群,但是USP10的表达水平显著高于DTX3L。表型分析发现USP10对于GSCs的自我更新和GBM的生长至关重要,而DTX3L可以抑制GSCs的自我更新和肿瘤的生长,证实两者具有相反的功能。 随后,研究人员通过大量的生化实验在体内外明确了USP10和DTX3L对SATB2泛素化和稳定性的调控(图1a-j)。通过改变USP10和DTX3L的表达水平以及利用泛素化位点的突变,研究人员证明了Lys48连接的多泛素化在SATB2的激活中起着关键的作用(图1k-n)。通过质谱和定点突变,研究人员确定了SATB2发生泛素化的特定赖氨酸位点K266,并证实USP10和DTX3L可以拮抗调控SATB2 K266位点的泛素化修饰控制其稳定性、出入核,从而调控下游FOXM1基因的表达。
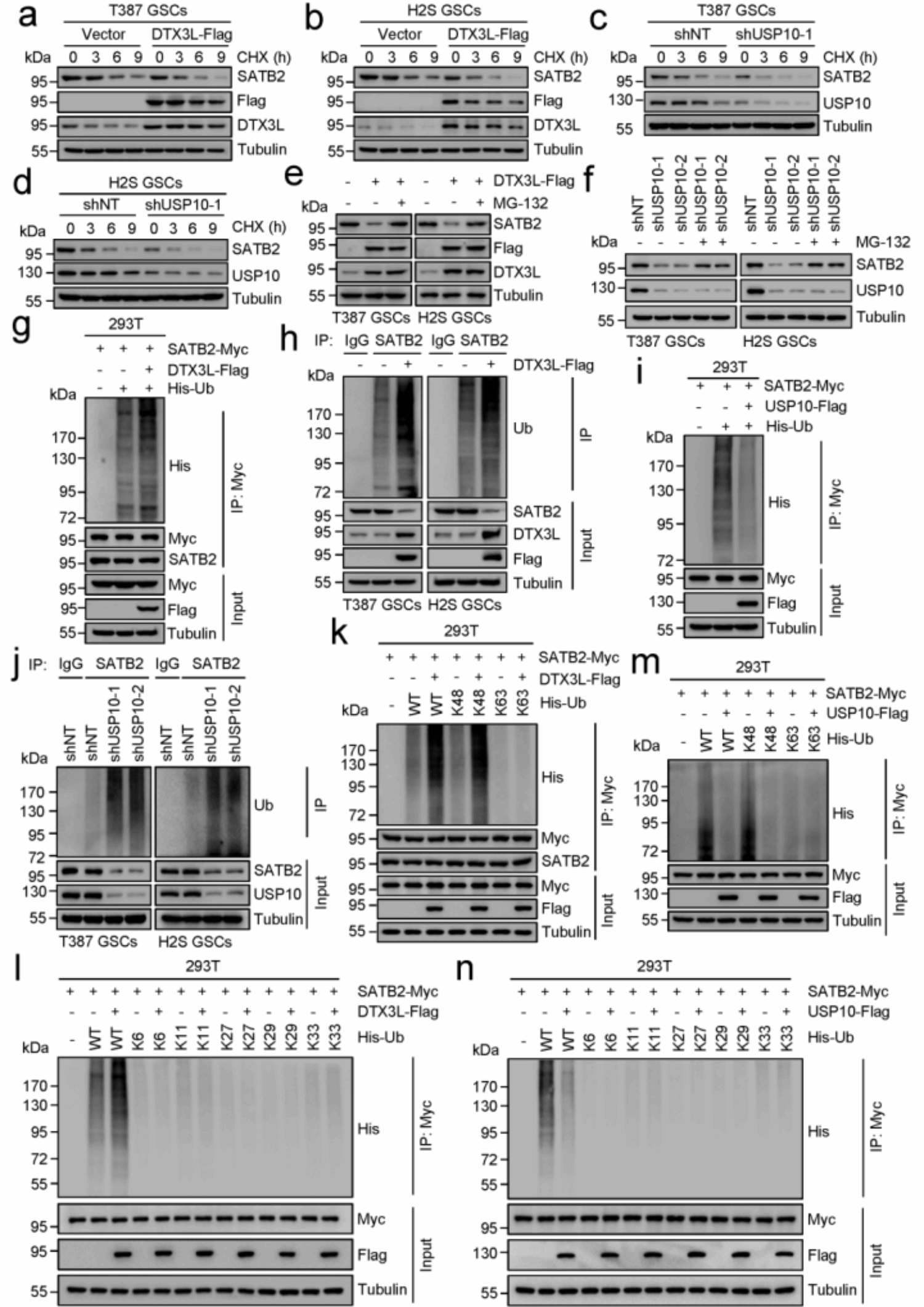
图1. DTX3L通过泛素化修饰介导SATB2的降解,而USP10则通过去泛素化稳定SATB2蛋白
此外,作者还鉴定出转录因子YY2在GSCs中富集,从而在转录水平上维持USP10在GSCs中的高表达。为了进一步阐明该研究的转化潜力,研究人员利用USP10的小分子抑制剂Wu-5来抑制USP10的活性。结果发现Wu-5处理可以显著抑制GSCs的自我更新并促进其分化。动物实验的结果也显示腹腔注射Wu-5后,小鼠颅内的肿瘤明显缩小,而对小鼠的体重没有显著影响。证实该小分子抑制剂具有较好的疗效和较小的副作用。
综上所述,该研究发现去泛素化酶USP10和E3泛素连接酶DTX3L主要由GSCs表达,通过拮抗作用调控SATB2 K266位点的泛素化水平、蛋白稳定性和出入核,进而调控下游基因FOXM1的表达以驱动GSCs的自我更新和GBM的颅内生长(图2)。利用小分子药物Wu-5靶向抑制USP10, 可打破该稳态平衡,诱导SATB2降解,从而显著抑制GSCs的功能和肿瘤生长(图2)。因此,靶向抑制USP10将可能成为潜在的GBM药物开发策略。
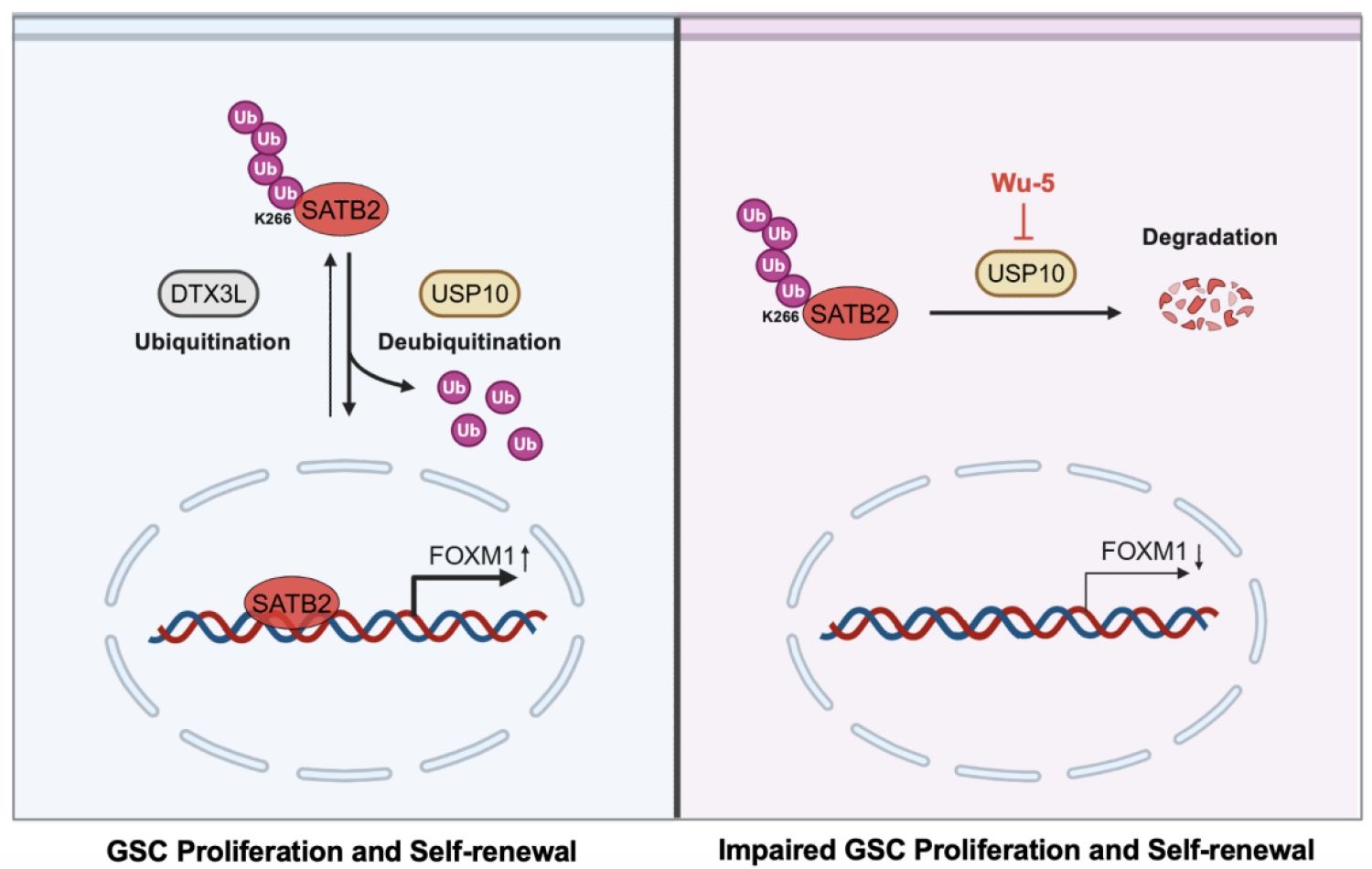
图2. USP10与DTX3L拮抗调控SATB2稳定性及GSCs自我更新的示意图
华中农业大学生命科学技术学院、生物医学与健康学院陶伟伟研究员与董志强教授为该论文的共同通讯作者,博士研究生郭孟悦为第一作者。南京医科大学汪秀星教授,十堰市太和医院秦军教授,华中科技大学同济医院舒凯教授、张所军教授,军事医学科学院满江红研究员,中国科学技术大学周文超研究员,华中农业大学张敏教授、张晓妍教授、包文骀副教授,南京中医药大学附属医院赵宁伟教授等也给予课题很多宝贵建议和帮助。
论文链接:https://www.nature.com/articles/s41467-025-67418-9
英文摘要:
Special AT-rich sequence-binding protein 2 (SATB2) is a nuclear matrix-associated protein with a pivotal role in glioblastoma (GBM) progression. However, the mechanisms underpinning aberrant SATB2 expression remain elusive. Here, we identify the ubiquitin specific peptidase 10 (USP10) as a deubiquitinase and the deltex E3 ubiquitin ligase 3 L (DTX3L) as a ubiquitin ligase of SATB2 in glioma stem cells (GSCs). USP10 and DTX3L regulate SATB2 ubiquitination at the K266 residue through mutually exclusive interactions and opposing activities. USP10, enriched in GSCs, is induced by transcription factor YY2. Knockdown of USP10 or overexpression of DTX3L markedly downregulates SATB2, resulting in the inhibition of GSC self-renewal and GBM growth, which can be rescued by the overexpression of SATB2. Importantly, pharmacological inhibition of USP10 by Wu-5 effectively suppresses tumor growth. These findings highlight the antagonistic roles of USP10 and DTX3L in the regulation of GBM malignancy and propose USP10 as a potential therapeutic target.
审核人:陶伟伟