南湖新闻网讯(通讯员 张伟祥)近日,我校资源与环境学院环境与生物分析团队在广谱抗菌聚合物研究领域取得重要进展,相关成果以封面论文“Modulating cationic-hydrophobic balance in hydrogel polymer nanoparticles for enhanced membrane interactions and antibacterial functions”发表于学术期刊Journal of Controlled Release。该研究构建了模块化水凝胶聚合物纳米颗粒合成平台,通过调控阳离子-疏水性平衡精准筛选出具有广谱抗菌功效的水凝胶聚合物纳米颗粒,系统阐明了阳离子和疏水性基团对聚合物与细菌膜相互作用及其抗菌活性的协同影响机制,为新型抗菌材料的发现、设计和开发提供了新的策略,有效减少了抗菌药物研究中对传统经验性筛选的依赖。
细菌性疾病对公众健康构成严重威胁,其中抗生素滥用导致的细菌多重耐药性使得耐药细菌感染的治疗尤为严峻。因此,迫切需要开发新的治疗策略以应对耐药细菌感染问题。抗菌聚合物结构上模仿了两亲性抗菌肽,表现出强大的抗菌活性,且具有结构多样性,有望成为一类具有广阔应用前景的新型抗菌药物。抗菌聚合物中的阳离子基团可通过强静电作用靶向带负电荷的细菌膜成分,而其疏水基团则能够诱导膜破裂,最终导致细菌死亡。这种靶向膜的作用机制绕过了细菌细胞内信号传导过程,从而可以有效抑制细菌耐药性的发展。尽管聚合物的两亲性对其与细菌膜的相互作用至关重要,但过高的阳离子密度或过强的疏水性反而会降低抗菌活性,增加细胞毒性,进而限制这类抗菌聚合物的临床应用。目前,该领域的研究仍主要依赖广泛筛选与聚合后修饰,对于阳离子与疏水性单体如何协同影响聚合物的抗菌活性、生物相容性、膜相互作用及抗菌机制等的理解仍非常有限。
本研究利用水凝胶聚合物的可设计性,通过调控单体组成与比例,实现了抗菌聚合物的模块化制备及抗菌功能的快速、精准优化,并系统阐明了阳离子与疏水性之间的平衡是如何决定其抗菌活性,影响其抗菌机制的。该研究首先以三种电荷密度不同的碱性氨基酸单体(MArg,MLys,MHis)作为阳离子供体,以四种不同的烷烃单体(C2,C4,C6,C8)作为疏水基团供体,构建了一系列具有不同阳离子电荷密度与疏水强度的水凝胶聚合物纳米颗粒。通过筛选,确定C4-MArg/MLys聚合物纳米颗粒具有最优的抗菌活性和膜结合能力(图1)。随后的研究揭示出一种关键协同作用机制:尽管阳离子电荷密度对抗菌活性至关重要,但其有效性完全依赖于与之匹配的疏水链长度,即疏水强度。一旦疏水强度偏离最优范围,其抗菌活性则会显著降低。烷烃单体一方面可以通过疏水相互作用增强聚合物与细菌膜表面的结合,而另一方面又会通过电荷屏蔽效应削弱聚合物表面电荷分布。这种阳离子-疏水性失衡是导致聚合物与细菌结合力减弱的主要原因。相比之下,阳离子单体主要通过静电吸引促进细菌聚集,这种聚集作用虽能增强抗菌效果,但其抗菌活性与细菌聚集程度并未呈现出简单的正比关系(图2)。更深入的机制研究表明,水凝胶聚合物纳米颗粒能够与细菌膜关键成分,即革兰氏阴性菌表面的脂多糖(LPS)和革兰氏阳性菌表面的磷壁酸(LTA)结合,破坏膜结构完整性,引起细胞质泄漏,最终导致细胞裂解与细菌死亡(图3)。
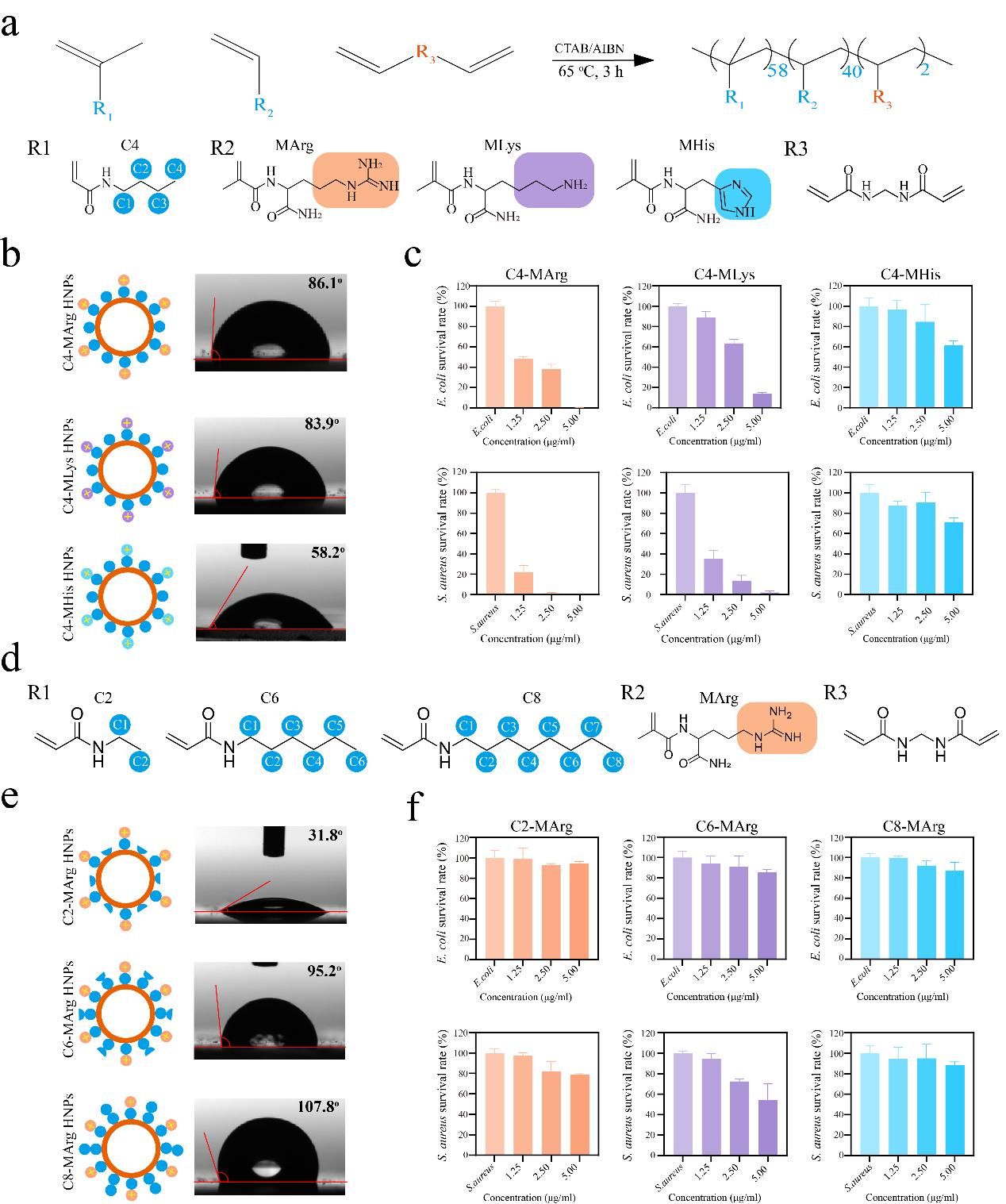
图1 不同电荷密度和疏水性的水凝胶聚合物纳米颗粒文库的构建及其抗菌活性筛选
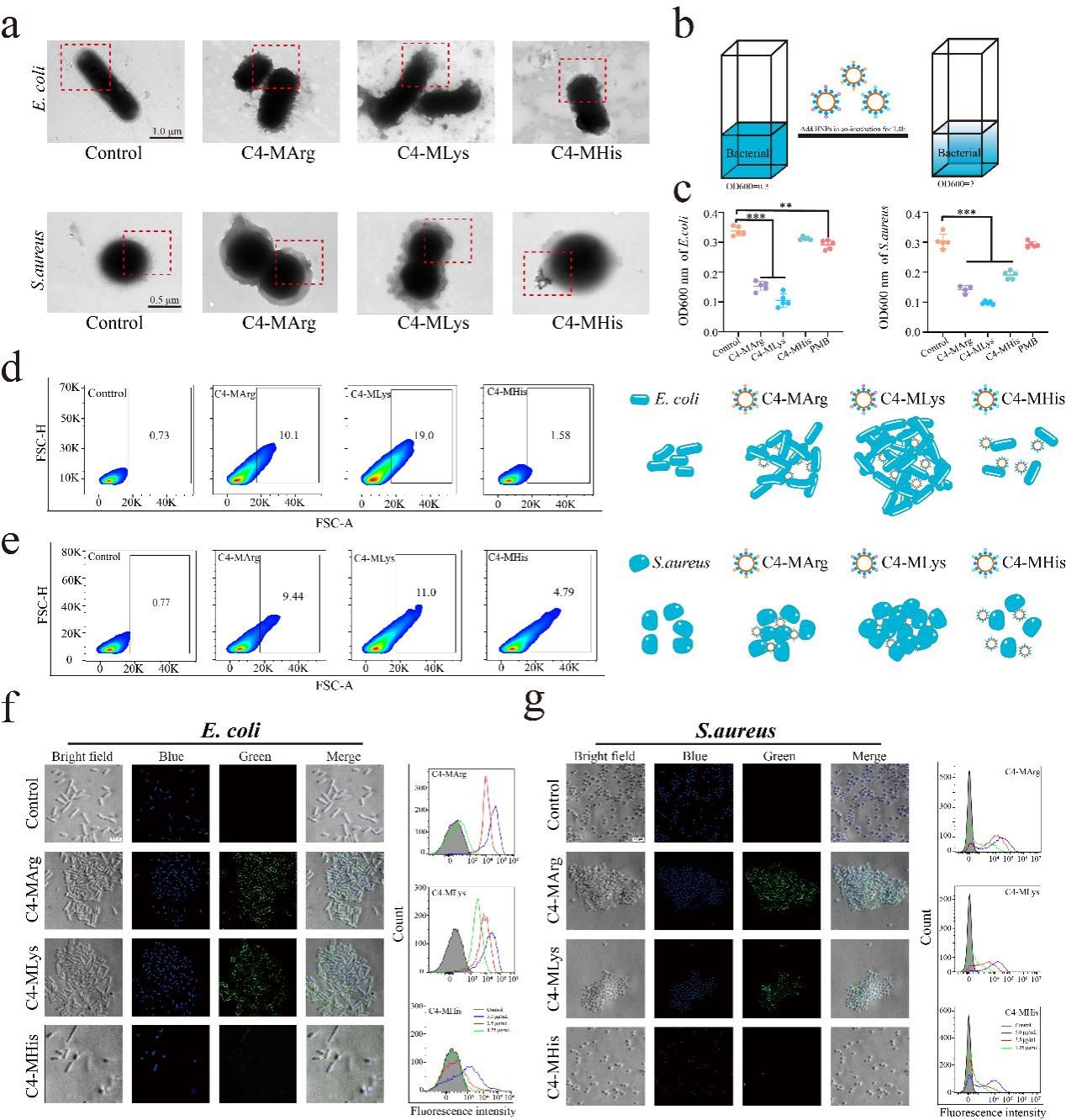
图2 不同电荷密度水凝胶聚合物纳米颗粒对细菌的结合和凝集能力评价
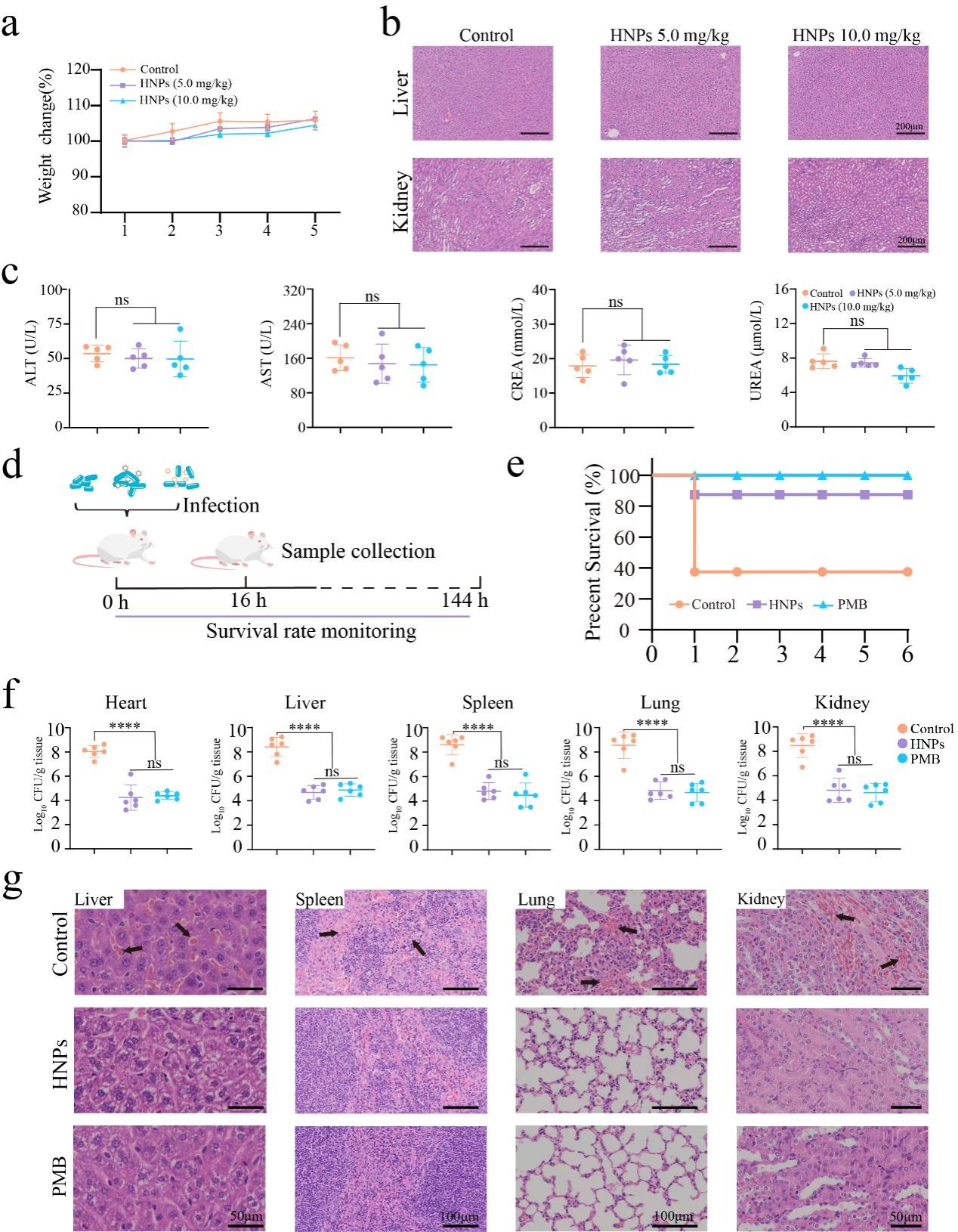
图3 C4-MArg水凝胶聚合物纳米颗粒对大肠杆菌感染小鼠的抗菌活性评价
我校资源与环境学院博士生张伟祥为论文第一作者,刘名茗教授为论文通讯作者,谭文峰教授、万田英高级工程师、水产学院袁改玲副教授对本研究也提供了重要指导。该研究得到国家自然科学基金(22374053和21976064)和中央高校基本科研业务费专项资金(2662019PY056)等项目的资助。
审核人:刘名茗
论文链接:https://doi.org/10.1016/j.jconrel.2025.114452
【英文摘要】
Cationic amphiphilic polymers have shown great potential in addressing public health challenges posed by drug-resistant bacteria. However, achieving high antibacterial efficacy requires precise regulation of the cationic-hydrophobic balance through rational monomer selection. Herein, we synthesized a library of hydrogel polymer nanoparticles (HNPs) by incorporating different cationic (MArg, MLys, MHis) and hydrophobic (C2, C4, C6, C8) monomers, aiming to explore the roles of these monomers in regulating the cationic-hydrophobic balance and thereby the antibacterial performance of the HNPs. Potent antibacterial efficacy was achieved for C4-MArg HNPs (nearly 100 % mortality against E. coli and S. aureus at HNP doses of 5 and 2.5 μg/mL, respectively) as an optimal cationic-hydrophobic balance was attained between MArg and C4 moieties with no mutual shielding or antagonistic effects from steric hindrance. Polymer-bacterium interactions, predominantly electrostatic forces, triggered bacterial aggregation, which correlated positively with the surface potentials of the HNPs. C4-MLys HNPs with the highest surface potential (+82.5 mV) showed the highest bacterial adhesion efficiency (over 80 % at a dose of 5.0 μg/mL within 30 min). These HNPs induced bacterial death through binding to lipopolysaccharides or lipoteichoic acids, disrupting bacterial membranes and causing cytoplasmic leakage. The screened C4-MArg HNPs demonstrated good biocompatibility and therapeutic efficacy, achieving a 50 % enhancement in survival rate compared to the control group in a murine systemic infection model. These findings establish precise modulation of the cationic-hydrophobic balance as a powerful strategy to optimize the antibacterial potency of HNPs, offering insights for the discovery, design and development of advanced broad-spectrum antibacterial materials.