南湖新闻网讯(通讯员 杨丹)近日,华中农业大学动物科学技术学院、动物医学院王湘如教授团队在国际期刊Science Advances发表研究论文“Transition of Pseudorabies Virus from Latency to Reactivation State Selectively Triggered by Pathogenic Bacteria”,首次系统揭示了猪群重要致病菌能够诱导潜伏伪狂犬病病毒(PRV)再活化的关键分子机制。研究发现,肠外致病性大肠杆菌(ExPEC)感染显著上调趋化因子CXCL1的表达,并激活STAT3信号通路,促进病毒早期基因转录,从而驱动潜伏病毒重新复制与释放。该成果为复杂混合感染环境下PRV的复发防控提供了新思路。
PRV是威胁全球养猪业的重要DNA病毒,可导致猪只呼吸道疾病、繁殖障碍以及仔猪高死亡率。近年来,我国陆续报道32例由PRV感染引起的人类病毒性脑炎病例,提示该病毒不仅危害畜牧业,还具有潜在跨物种传播风险,对公共卫生安全构成一定隐患。
与其他α疱疹病毒类似,PRV在急性感染后可在猪的外周神经系统(如三叉神经节)中长期潜伏。当宿主遭遇应激或免疫抑制时,潜伏病毒极易被重新活化,造成疾病暴发和病毒传播。尽管疫苗免疫已大幅降低PRV的流行程度,但潜伏感染的再活化仍是产业防控的核心难题之一。
在实际生产中,大肠杆菌常与伪狂犬病病毒、猪圆环病毒等多种病原体形成混合感染,导致临床症状加重、治疗难度增加并加剧经济损失。基于这一生产实践中的现象,王湘如教授团队敏锐抓住“病原混合感染”这一常见却最容易被忽视的关键环节,率先系统验证了特定致病性细菌可直接“唤醒”潜伏 PRV,从而揭开潜伏病毒再活化背后的重要线索。
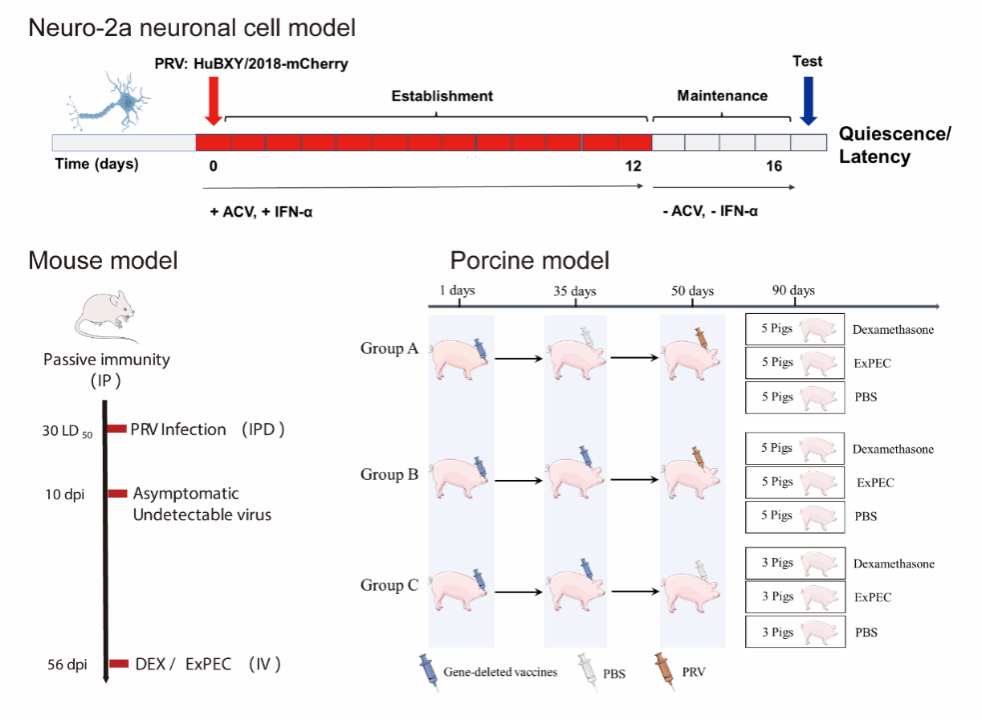
为系统解析病原菌对潜伏PRV再活化的影响,研究团队构建了包括Neuro-2a神经元细胞、小鼠及猪在内的多层次潜伏感染模型。研究显示,ExPEC和部分猪链球菌(S. suis)能够显著诱导潜伏PRV从静息状态重新活化;相比之下,肠内致病性大肠杆菌(如ETEC等)和副猪格拉瑟菌(G. parasuis)并不具备这种能力。团队推测,这一差异可能源于ExPEC和部分S. suis菌株在猪体内能够引发急性感染,并诱导强烈的神经炎症反应,甚至具备突破血脑屏障、入侵中枢神经系统的能力,从而为潜伏病毒的重新活化创造了关键条件。在猪模型的进一步研究中,团队发现,加强免疫接种可显著提升机体中和抗体水平,并有效降低细菌感染后猪只的口腔再次排毒量和组织载毒量。这一结果表明,科学有效的免疫策略不仅能预防PRV的急性感染,还有助于抑制潜伏病毒的再活化。
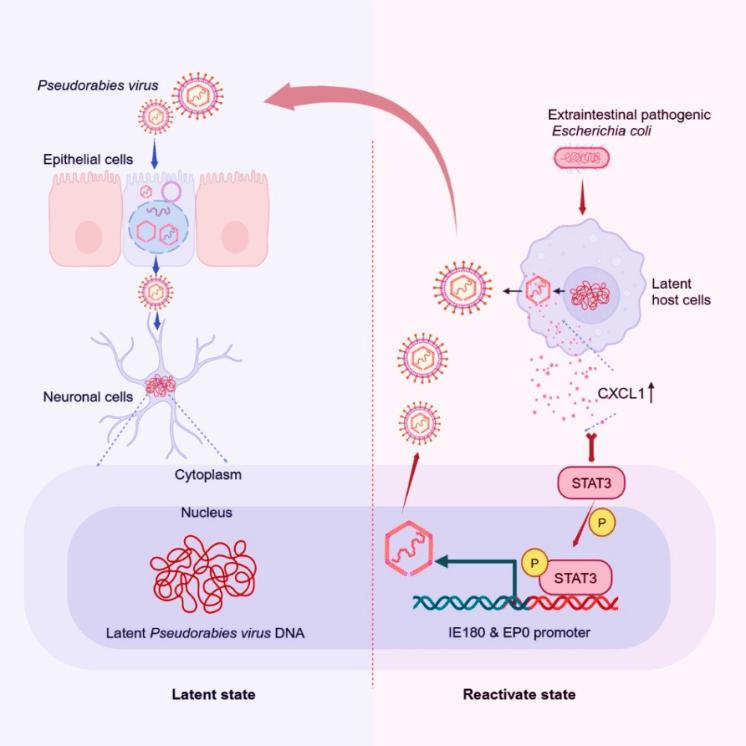
分子机制:CXCL1-STAT3信号轴驱动潜伏PRV的再活化
在深入解析分子机制的研究中,团队通过比较ExPEC感染诱导的病毒再活化状态与潜伏感染状态的差异发现,在病毒再活化过程中,神经元细胞中的CXCL1基因持续保持高水平转录。无论是通过在Neuro-2a神经元细胞中敲除CXCL1基因,还是在小鼠体内干扰CXCL1的表达,均能阻断或显著降低PRV的再活化,有力地表明CXCL1在这一过程中发挥关键作用。值得注意的是,在CXCL1敲除的细胞中,PRV的潜伏相关转录本转录水平显著上调,而病毒的增殖复制与出胞过程则受到明显抑制,这显示出 CXCL1 的缺失可能有助于维持病毒的静息感染状态。进一步的KEGG通路分析和Western blot结果显示,CXCL1可促进STAT3的磷酸化及核转位。通过双荧光素酶报告系统和 CUT&Tag 技术,团队发现并验证了 STAT3 磷酸化入核后与PRV立即早期基因IE180和早期基因EP0启动子的特定位点发生结合,进而调控其转录活性,最终驱动潜伏病毒重新复制和释放。此外,对 STAT3 磷酸化进行抑制能够显著抑制PRV的再活化,进一步确认了CXCL1-STAT3信号通路对于潜伏PRV的重新复制与活化至关重要。
该研究首次揭示了猪群重要致病菌感染诱发潜伏病毒再活化的现象与分子机制,同时强调了在养殖场中防控病原菌混合感染与加强免疫接种的重要意义。研究团队指出,在现代集约化养殖条件下,多种病原体共存,可能为潜伏病毒再活化提供多重刺激源。因此,提升养殖场生物安全水平、减少病原菌混合感染,以及科学实施免疫程序,将是降低PRV复发风险、保障猪群健康的重要措施。
华中农业大学动物科学技术学院、动物医学院杨丹博士为本论文第一作者,杨苗硕士(在读)、国师榜博士,呙会会博士、李亚菲博士(在读)等参与完成,王湘如教授为通讯作者。相关工作获得国家自然科学基金、重点研发计划项目以及教育部等有关项目的资助。
论文链接:Transition of pseudorabies virus from latency to reactivation state selectively triggered by pathogenic bacteria | Science Advances
英文摘要:
Pseudorabies virus (PRV) causes severe morbidity and mortality in pigs and must be eradicated from pig populations. The increasing PRV infections in humans—resulting in severe encephalitis, neurological sequelae, and death since 2017 in China—have also posed a public health risk. PRV can establish latency in pigs, potentially leading to disease outbreaks upon reactivation. However, little is known about the PRV reactivation process, particularly in cases with other pathogens coinfection. We found that extraintestinal pathogenic Escherichia coli and Streptococcus suis, common zoonotic bacteria found in pigs, can trigger PRV reactivation, and bacteria up-regulated CXCL1 to enhance STAT3 phosphorylation and nuclear translocation, which triggers PRV reactivation by regulating the transcription of early viral genes. Effective booster immunization significantly reduced PRV reactivation among pigs. Our work highlights the risk of bacterial coinfections on PRV reactivation, emphasizing the importance of adequate immunization for controlling PRV within pigs and reducing zoonotic transmission.
审核人:王湘如