自噬是一种高度保守的溶酶体依赖的细胞降解途径,对维持细胞稳态和生存至关重要。在DNA损伤条件下,自噬通过回收受损细胞成分,为DNA修复提供代谢支持,从而维持基因组稳定性。DNA损伤可通过激活AMPK或ATR-CHEK1-RHOB通路抑制mTORC1,进而启动自噬。此外,ATM、TP53调控的SESN1/2以及PARP1参与激活AMPK以诱导自噬,而MAPK8则通过磷酸化BCL2破坏其与BECN1的抑制性相互作用,从而触发BECN1依赖的自噬。
近日,生命科学技术学院、生物医学与健康学院张敏教授发表在Cell Death And Differentiation上题为TRIM21-driven K63-linked ubiquitination of RBM38c, as a novel interactor of BECN1, contributes to DNA damage-induced autophagy的研究发现了一种灵长类特异的RNA结合蛋白RBM38的亚型RBM38c。RBM38c在DNA损伤响应中被激活并发生泛素化,进而促进自噬的启动。RBM38由五个外显子组成,通过选择性剪接产生三种亚型,其中RBM38c比a型多32个氨基酸,因包含额外的外显子2。研究揭示了RBM38c在DNA损伤诱导的自噬中的关键作用,为理解自噬的调控机制提供了新的视角。
研究团队首先发现RBM38c是RBM38的一个新型亚型,比RBM38a多32个氨基酸。通过免疫沉淀和质谱分析,他们发现RBM38c可能与泛素相互作用。实验证实RBM38c而非RBM38a被泛素化,且第35位赖氨酸(K35)是泛素化的关键位点。进一步研究表明,这种泛素化主要是K63链接的,而非K48链接的泛素化。共表达实验显示RBM38c形成细胞质点状结构,与K63泛素共定位,这与RBM38a的分散分布不同。
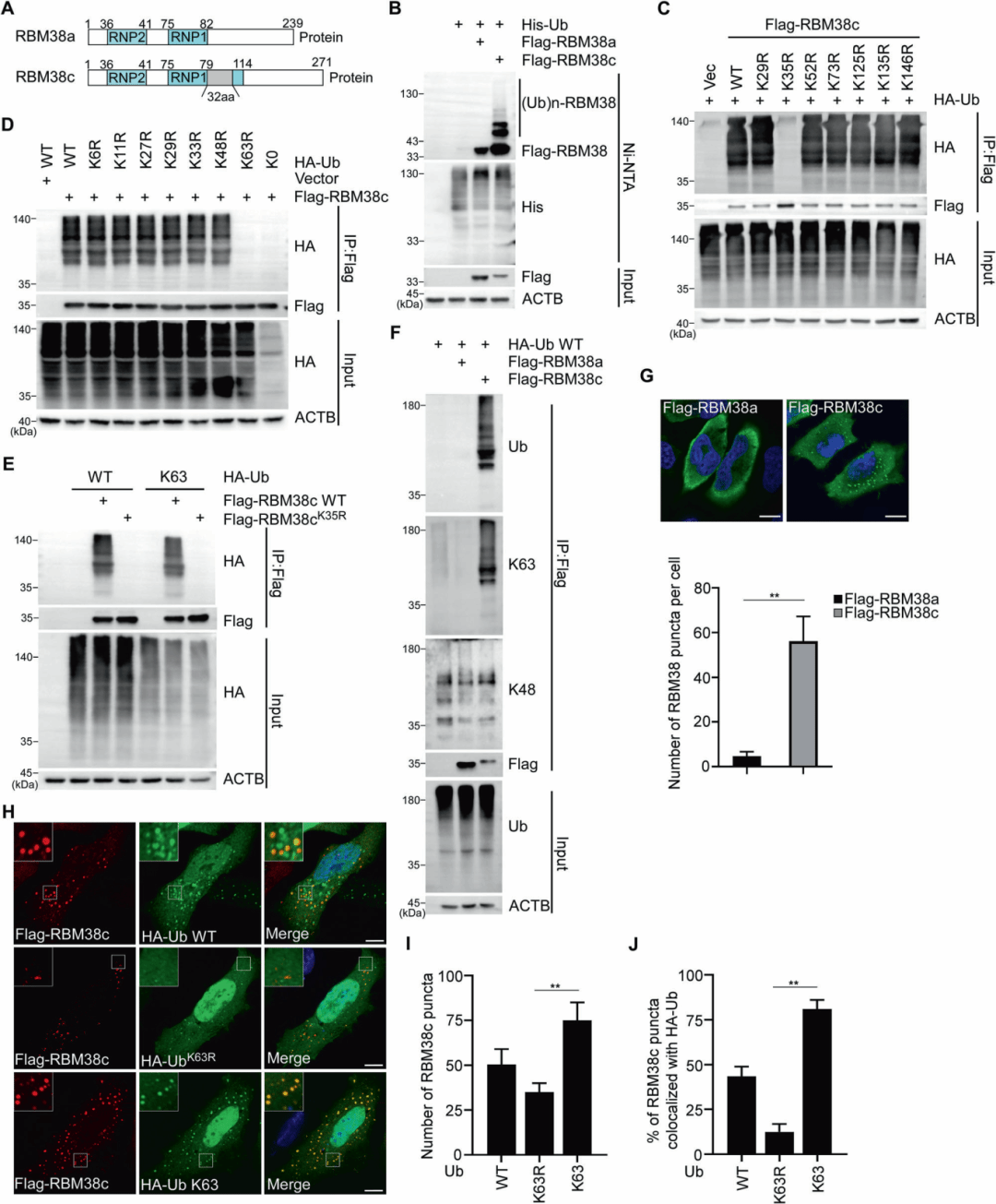
图1 RBM38c的发现与泛素化特性
有趣的是,RBM38c点状结构与自噬体显著重叠,尤其是与早期自噬标志物如ATG16L1和新月体标志物ZFYVE1共定位,而与晚期自噬标志物LAMP2共定位较弱。自噬诱导剂Torin1能有效促进RBM38c点状结构的形成。敲低RBM38c导致LC3B-II减少但SQSTM1增加,表明RBM38c在自噬中发挥作用。过表达RBM38c增加了LC3B-II水平并减少SQSTM1水平,而K35R突变体无明显影响,这证明RBM38c的泛素化对自噬至关重要。
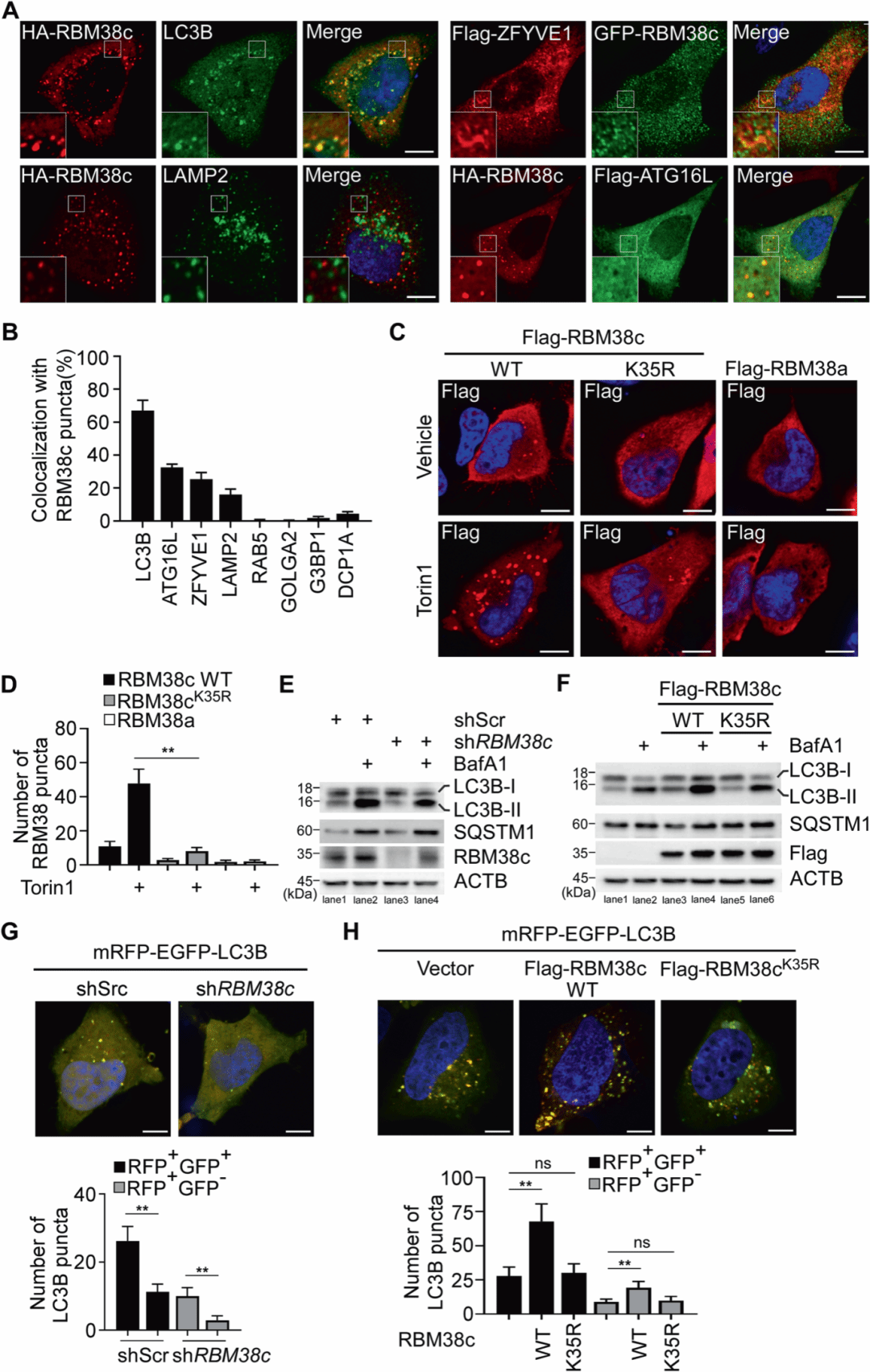
图2 RBM38c与自噬的关系
研究发现DNA损伤药物如喜树碱(CPT)或顺铂(CDDP)能增加RBM38c的mRNA和蛋白水平,这一转录激活依赖于TP53。此外,CPT或CDDP处理还增加了RBM38c的泛素化水平,质谱分析鉴定出TRIM21和STUB1两个潜在的E3泛素连接酶。进一步研究证实TRIM21而非STUB1介导RBM38c的K63链接泛素化,TRIM21的PRY-SPRY结构域与RBM38c的80-111氨基酸区域介导它们的相互作用。
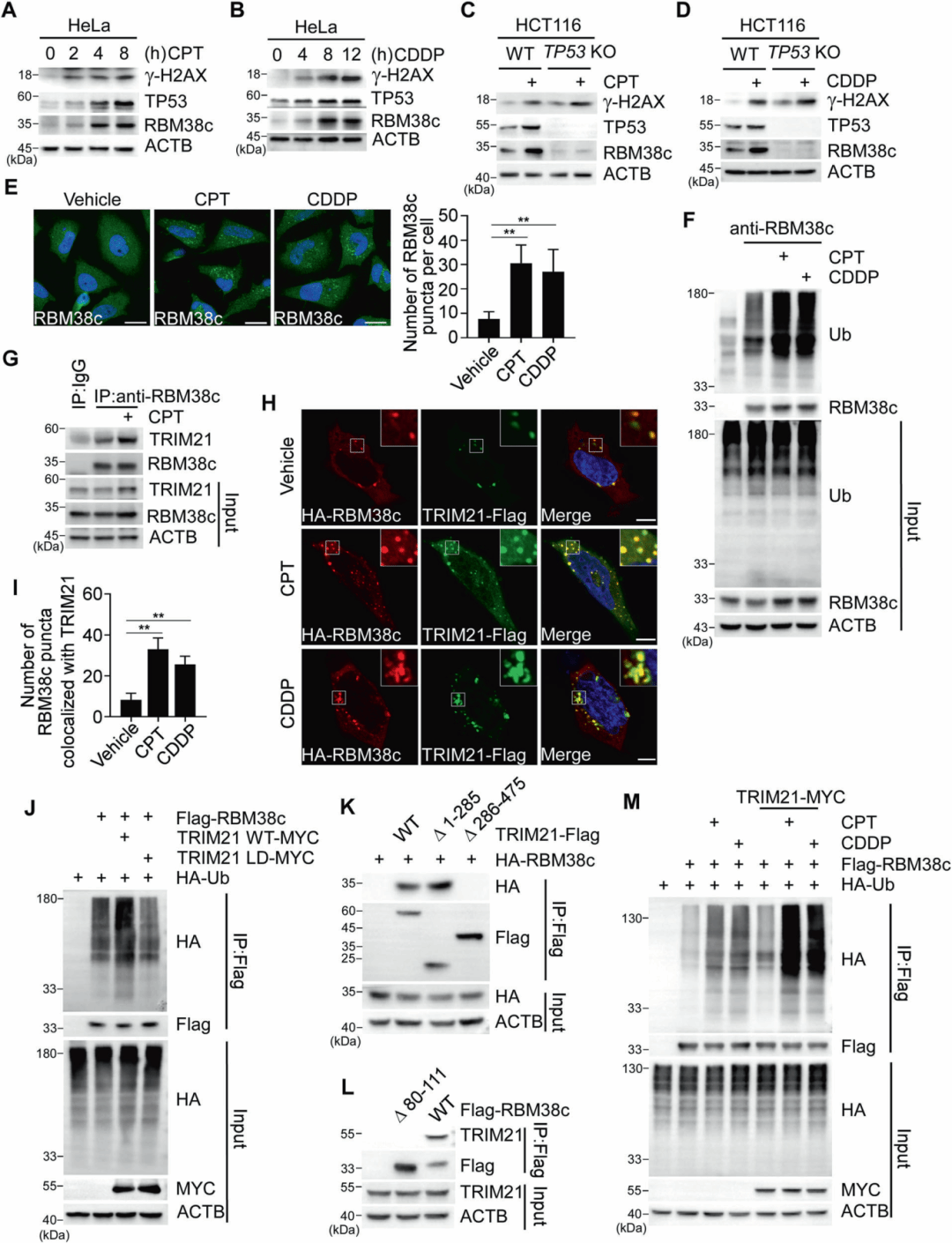
图3 DNA损伤对RBM38c的调控
DNA损伤条件下,RBM38c的泛素化增强了其与BECN1的相互作用。质谱分析揭示RBM38c可能与BECN1相互作用,免疫共沉淀证实了它们的内源性相互作用。BECN1的310-360氨基酸区域和RBM38c的180-225氨基酸区域介导它们的相互作用。重要的是,DNA损伤增强了RBM38c与BECN1的相互作用,但不增强RBM38a或RBM38c-K35R突变体与BECN1的相互作用,表明RBM38c的泛素化对这种相互作用至关重要。TRIM21表达增强了RBM38c与BECN1的相互作用,而在TRIM21敲除细胞中,DNA损伤不再增强二者的相互作用和共定位。
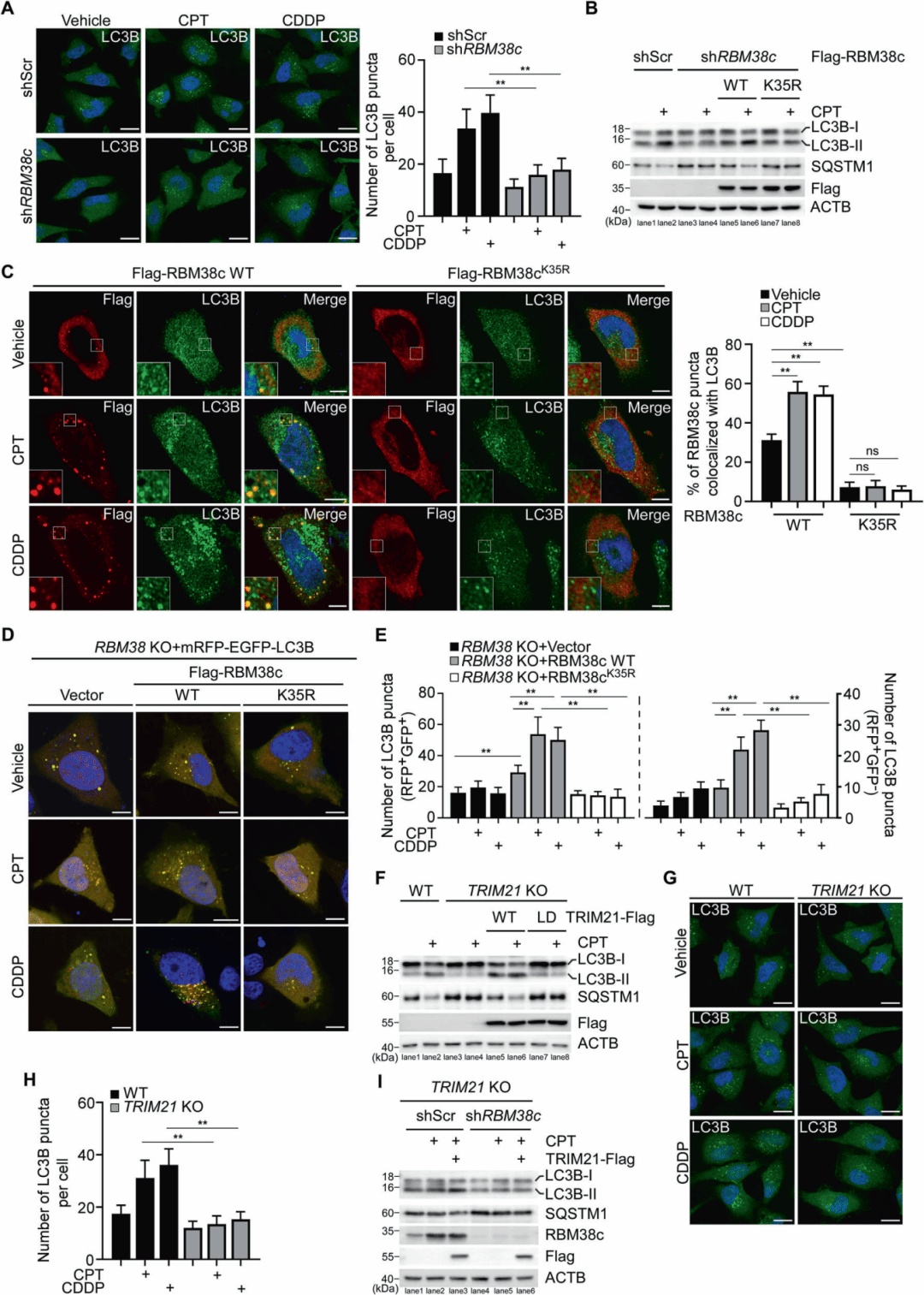
图4 RBM38c与BECN1的相互作用
进一步研究表明,RBM38c特异性地与ATG14而非UVRAG相互作用,表明它优先与PtdIns3K-C1复合物相关联。DNA损伤增强了RBM38c与ATG14和PIK3C3的相互作用和共定位,而K35R突变体则没有这种效应。RBM38c敲低显著减少了BECN1与ATG14和PIK3C3的相互作用,DNA损伤诱导的BECN1与这些伙伴的共定位也被抑制。GFP-FYVE报告系统表明,DNA损伤增加了GFP-FYVE点状结构,表示PtdIns3P募集,而RBM38c敲低显著减少了这种点状结构的形成。体外激酶试验证明,DNA损伤诱导的PIK3C3激酶活性受RBM38c表达调控,而TRIM21敲除抑制了DNA损伤诱导的内源性RBM38c与PtdIns3K-C1的相互作用,降低了PIK3C3激酶活性。
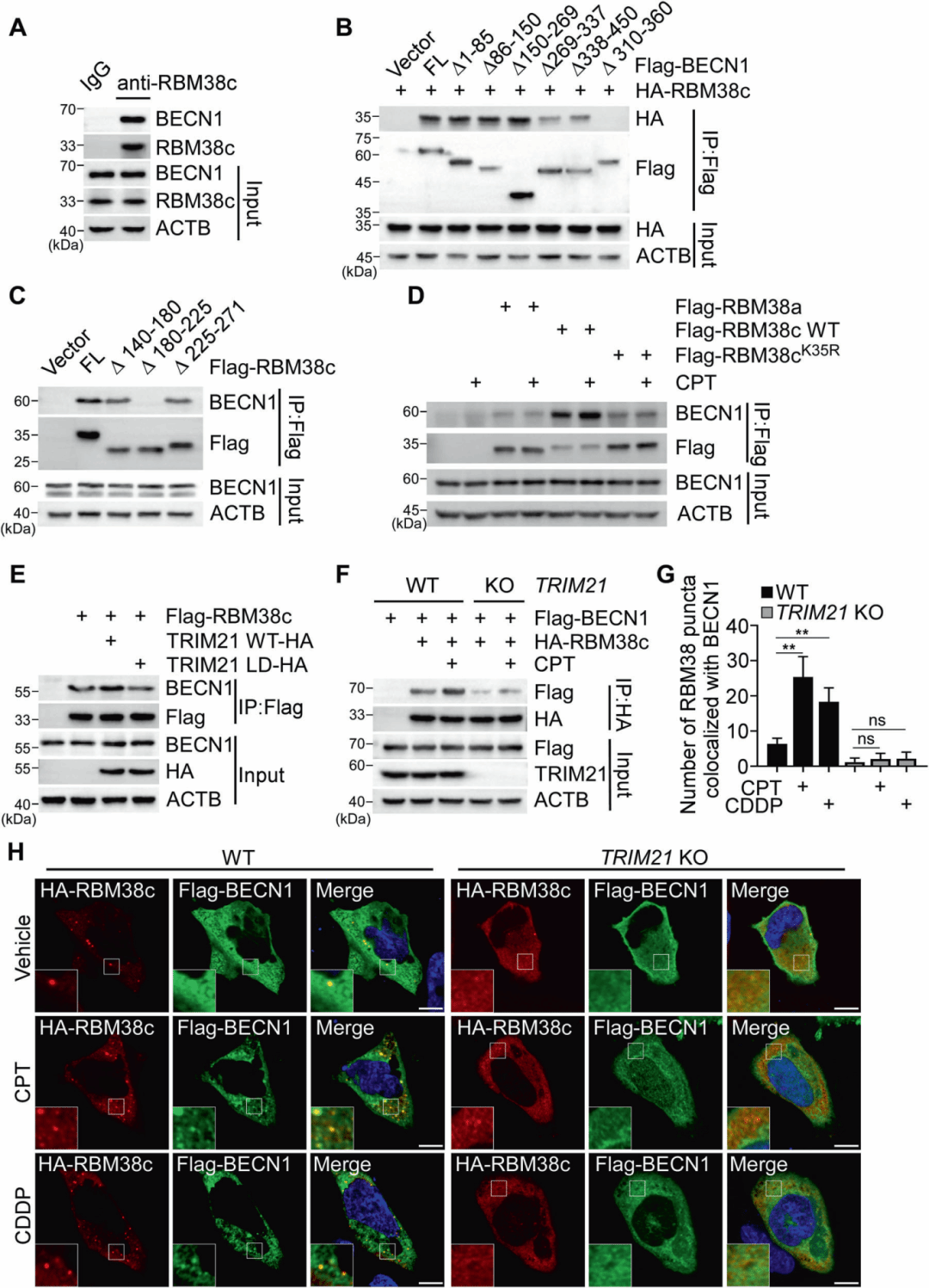
图5 RBM38c与PtdIns3K-C1复合物的相互作用
临床样本中的RBM38c表达与化疗抵抗。最后,研究人员探讨了RBM38c依赖的自噬在DNA损伤条件下的作用。CPT或CDDP处理降低了细胞活力,而RBM38c但非K35R突变体表达恢复了细胞活力,这种保护作用可被自噬抑制剂3-MA消除。RBM38c表达抑制了DNA损伤诱导的凋亡,这也可被3-MA抵消。RBM38c敲低进一步增加了DNA损伤诱导的cleaved CASP3和cleaved PARP1水平,表明凋亡增强。相反,RBM38c表达降低了cleaved CASP3水平,但3-MA处理抵消了这种作用。
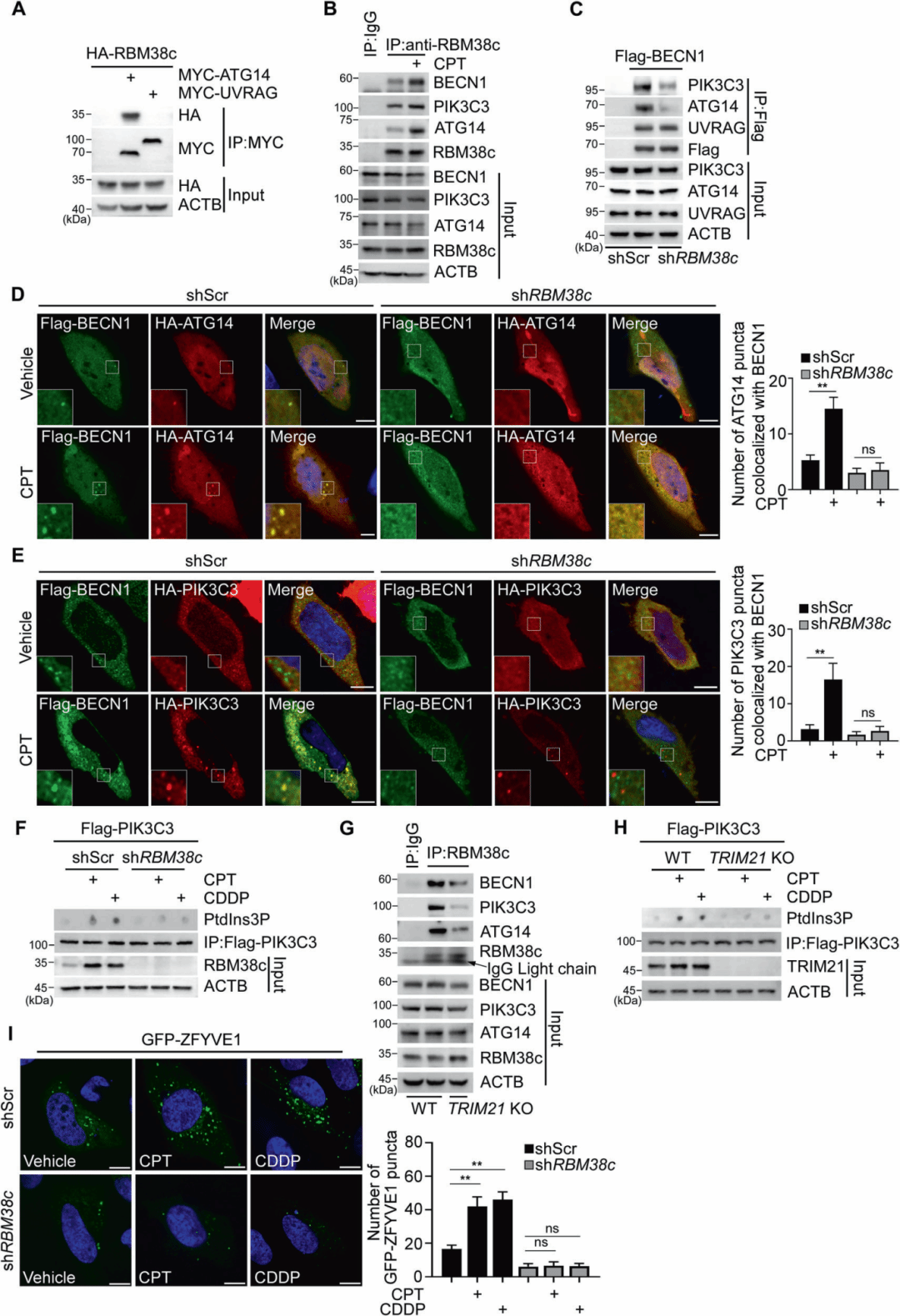
图6 RBM38c依赖的自噬在DNA损伤中的作用
在临床肺癌样本中,RBM38c表达与LC3表达呈正相关,与化疗抵抗相关。相比化疗敏感患者,化疗抵抗患者表现出更高水平的RBM38c和LC3表达,以及更低水平的cleaved CASP3,表明自噬增强而凋亡减少。相关性分析证实,RBM38c表达与LC3表达呈显著正相关(rs = 0.466, P < 0.01),而与cleaved CASP3表达呈显著负相关(rs = -0.316, P < 0.01)。
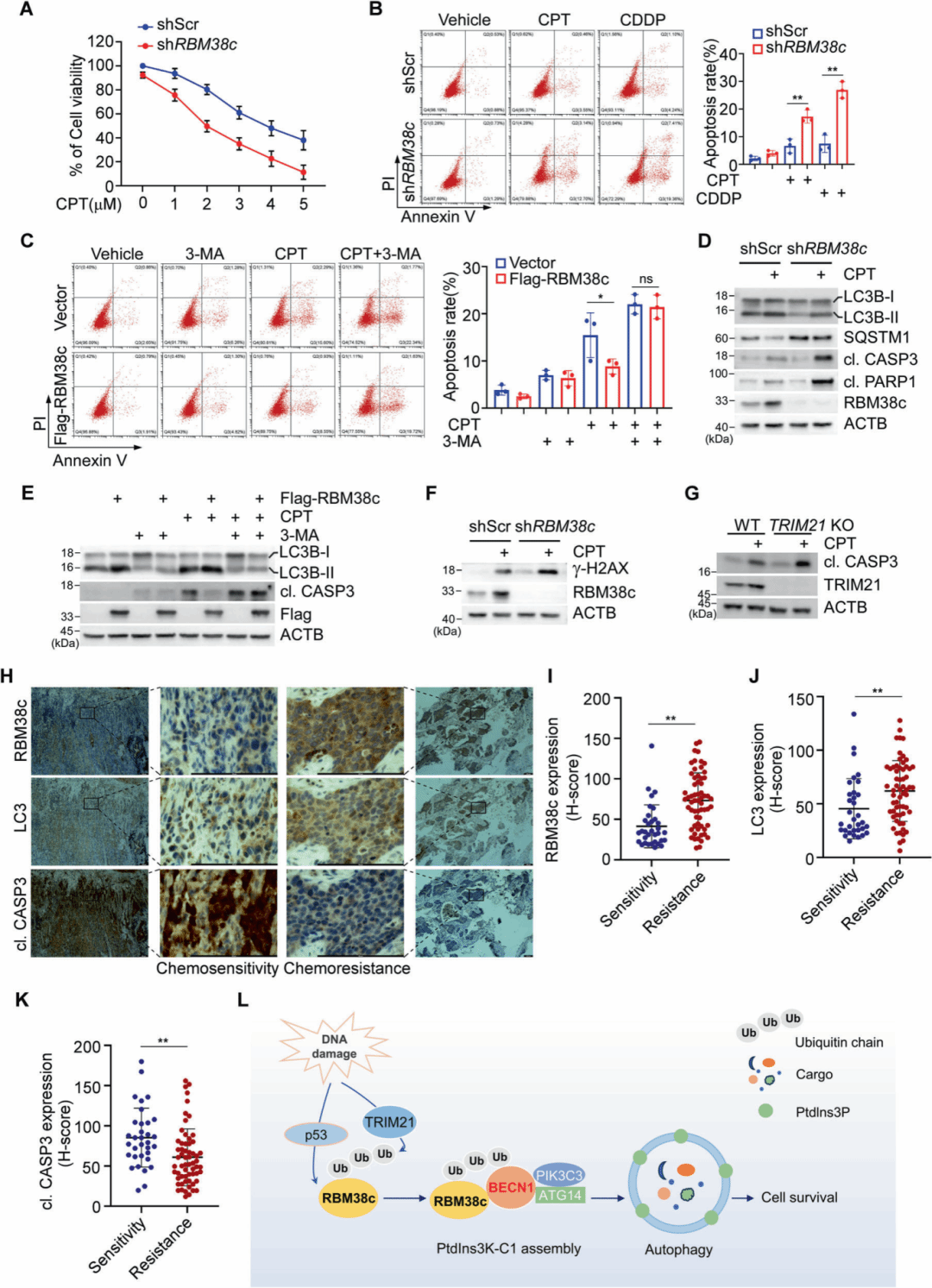
图7 临床样本中的RBM38c表达与化疗抵抗
本研究鉴定出RBM38的新型亚型RBM38c,其在DNA损伤响应中通过启动自噬发挥关键作用。RBM38c通过促进ATG14-PtdIns3K-C1复合物的组装来激活自噬,且其功能依赖于TRIM21介导的K63链泛素化。DNA损伤通过TP53依赖性途径上调RBM38c的表达,并增强其与BECN1的相互作用,从而促进自噬复合物的形成,保护细胞免受凋亡。RBM38c的32个额外氨基酸是灵长类动物特有的,且在临床肺癌样本中,其表达与自噬标志物LC3正相关,并与化疗抵抗相关。这些发现揭示了RBM38c-TRIM21-BECN1轴在自噬调控中的新机制,并为癌症治疗提供了潜在的新靶点。
审核:张敏