南湖新闻网讯(通讯员 刘鑫 张晶晶)近日,我校动物科学技术学院、动物医学院苗义良团队研究成果以“Hierarchical Accumulation of Histone Variant H2A.Z Regulates Transcriptional States and Histone Modifications in Early Mammalian Embryos”为题在Advanced Science发表。研究针对鼠猪早期胚胎系统地揭示了H2A.Z在早期胚胎发育过程中的动态分布规律,并首次证实了H2A.Z的分级富集参与调节哺乳动物早期胚胎的基因表达和组蛋白修饰状态。
在哺乳动物早期胚胎发育过程中,DNA甲基化、组蛋白修饰和染色质三维结构等表观遗传信息经历了剧烈的重编程,这对胚胎内基因表达的精确调控至关重要。组蛋白变体H2A.Z在基因组上的掺入和移除也是一种重要的表观遗传信息,然而其在早期胚胎发育过程中的全基因组分布和动态变化规律仍然未知。与DNA复制偶联的经典组蛋白不同的是,组蛋白变体H2A.Z会主动替换特定位置的经典组蛋白H2A,从而调控多种生物学事件的发生。在此过程中,组蛋白分子伴侣ANP32E和染色质重塑复合物SRCAP分别特异地调控H2A.Z在基因组上的移除和掺入。目前已知H2A.Z和SRCAP的缺失会导致小鼠植入前胚胎死亡,提示H2A.Z对于正常胚胎发育具有重要意义,然而H2A.Z如何在早期胚胎中发挥其生物学功能还需要更进一步的研究。
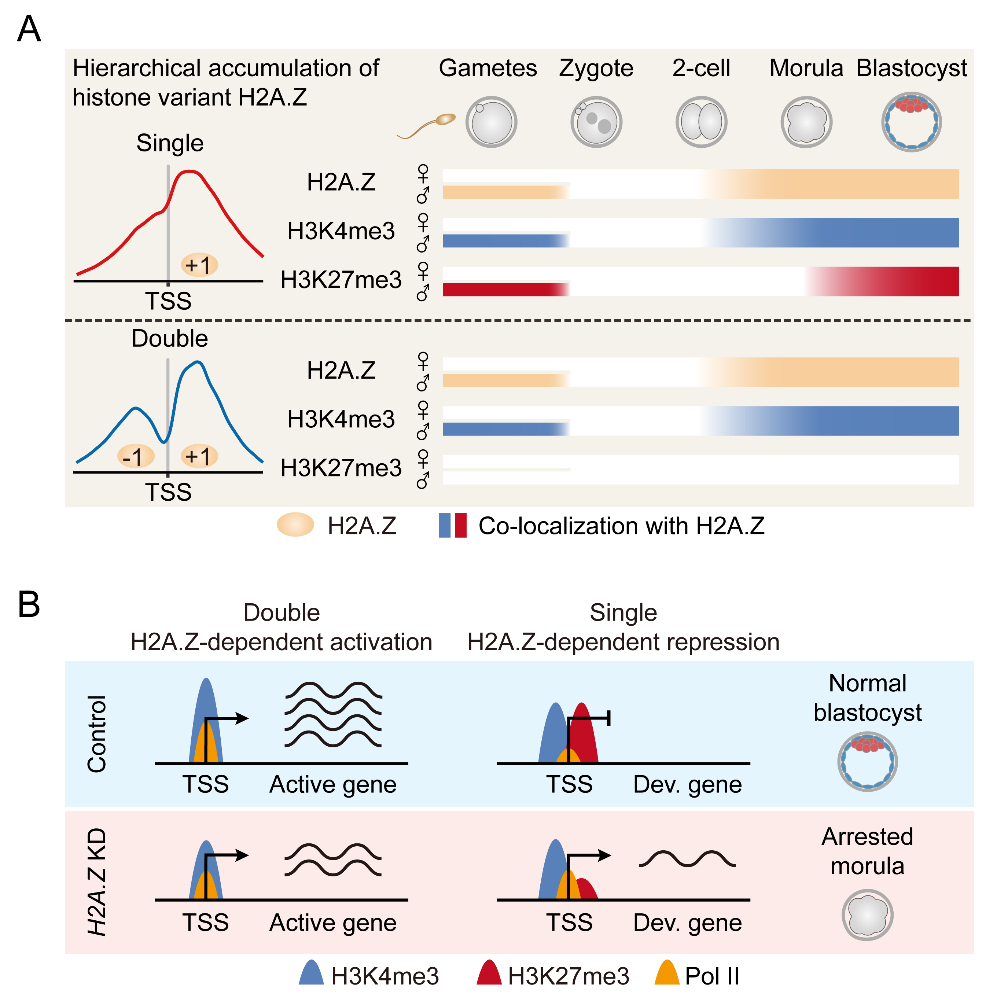
研究人员首先使用ULI-NChIP-seq技术检测了卵母细胞和早期胚胎发育过程中H2A.Z在基因组分布的动态变化,并使用孤雌胚胎和精子H2A.Z ChIP-seq数据探究该组蛋白变体在亲本基因组之间的富集差异。研究人员发现H2A.Z未掺入卵母细胞的基因组,而精子基因组上的H2A.Z会在受精后被整体移除,随后在合子基因组激活(ZGA)期间,H2A.Z会无偏好地掺入双亲基因组。
H2A.Z在早期胚胎中的分层富集和功能研究
为了进一步明确H2A.Z在早期胚胎发育过程中扮演的角色,研究人员将胚胎H2A.Z的富集数据与胚胎转录组和RNA聚合酶Ⅱ(PolⅡ)富集数据进行联合分析,发现H2A.Z在基因启动子上的富集模式与转录活性相关,而与H2A.Z的富集信号强度无线性关系。其中H2A.Z在活性基因启动子上呈“双峰”富集模式,而在非活性基因启动子上呈“单峰”富集模式。早先发现,胚胎干细胞中的H2A.Z会在启动子上招募编写H3K4me3的MLL复合体和编写H3K27me3的PRC2复合体4。因此,研究人员进一步联合胚胎H3K4me3和H3K27me3的富集数据,经分析发现:呈“单峰”H2A.Z的启动子具有更高比例的H3K4me3和H3K27me3共定位情况,而呈“双峰”H2A.Z的启动子具有更高比例的H3K4me3独占情况。作者随后在合子中使用显微注射技术敲降H2A.Z,并检测了H2A.Z敲降胚胎的基因表达改变和PolⅡ、H3K4me3和H3K27me3在基因组内的富集变化。结果显示,H2A.Z敲降后胚胎阻滞在桑椹胚时期,其中上调基因启动子上的H2A.Z呈“单峰”富集,并且H3K27me3的富集水平显著降低;而下调基因启动子的H2A.Z呈“双峰”富集,并且H3K4me3的富集水平显著降低。最后,研究人员还在猪早期胚胎中明确了H2A.Z保守的富集和调控功能,以及桑椹胚阻滞的敲降表型。上述结果说明哺乳动物早期胚胎谱系分化的初期需要H2A.Z的正确富集。
我校动物科学技术学院、动物医学院苗义良教授为论文的通讯作者,刘鑫副研究员和张晶晶博士生为论文的共同第一作者。该研究受到国家自然科学基金委员会、湖北省重点研发计划、湖北洪山实验室、华中农大校创基金等项目的资助。
审核人:苗义良
【英文摘要】
Early embryos undergo extensive epigenetic reprogramming to achieve gamete-to-embryo transition, which involves the loading and removal of histone variant H2A.Z on chromatin. However, how does H2A.Z regulate gene expression and histone modifications during preimplantation development remains unrevealed. Here, by using ultra-low-input native chromatin immunoprecipitation and sequencing, the genome-wide distribution of H2A.Z is delineated in mouse oocytes and early embryos. These landscapes indicate that paternal H2A.Z is removed upon fertilization, followed by unbiased accumulation on parental genomes during zygotic genome activation (ZGA). Remarkably, H2A.Z exhibits hierarchical accumulation as different peak types at promoters: promoters with double H2A.Z peaks are colocalized with H3K4me3 and indicate transcriptional activation; promoters with a single H2A.Z peak are more likely to occupy bivalent marks (H3K4me3+H3K27me3) and indicate development gene suppression; promoters with no H2A.Z accumulation exhibit persisting gene silencing in early embryos. Moreover, H2A.Z depletion changes the enrichment of histone modifications and RNA polymerase II binding at promoters, resulting in abnormal gene expression and developmental arrest during lineage commitment. Furthermore, similar transcription and accumulation patterns between mouse and porcine embryos indicate that a dual role of H2A.Z in regulating the epigenome required for proper gene expression is conserved during mammalian preimplantation development.
论文链接:https://doi.org/10.1002/advs.202200057