南湖新闻网讯(通讯员 田忠 王蔻) 近日,我校植物科学技术学院昆虫资源与行为利用团队王小平课题组在《美国国家科学院院刊》(PNAS)上发表了题为“The PBAP chromatin remodeling complex mediates summer diapause via H3K4me3-driven juvenile hormone regulation in Colaphellus bowringi”的研究成果。该研究揭示了染色质重塑复合体PBAP(Polybromo-associated BAF)作为光周期信号的“解码器”,通过调控保幼激素(juvenile hormone,JH)的合成,决定昆虫生殖滞育发生的分子机制。该研究不仅为基于滞育操纵的害虫生态防控和资源昆虫利用提供了新的分子靶标,还为深入理解动物的季节性适应机制提供了全新视角。

在自然界中,季节更替通常伴随着高温、严寒及食物短缺等环境变化,对生物的生存构成严峻挑战。众多动物,尤其是昆虫,在长期进化过程中形成了滞育(休眠)特性,使其能够通过暂停发育、积累脂肪、降低代谢水平并增强抗逆能力,以度过不利环境。光周期作为一种稳定的季节性信号,通过调控昆虫内分泌系统诱导滞育。然而,在滞育发生过程中,非生物的光周期信号如何被转化为昆虫的内分泌信号,仍是困扰科学家的一个难题。十字花科蔬菜害虫大猿叶虫Colaphellus bowringi具有典型的夏季滞育特性,在长光照条件下进入生殖滞育,即卵巢发育停滞并大量积累脂肪。该研究以大猿叶虫为研究对象,鉴定到一个响应光周期变化的生殖滞育调控基因——bap170,并揭示了其通过染色质重塑调控保幼激素(JH)合成,从而控制滞育发生的分子机制。
研究人员通过比较长光照(Long day)和短光照(Short day)条件下个体中的差异表达基因,获得了56个滞育调控候选基因。随后通过RNAi筛选和滞育表型分析发现,bap170通过特异性调控JH合成,决定生殖滞育发生。BAP170是PBAP染色质重塑复合体的核心亚基。SWI/SNF复合体是一类高度保守的染色质重塑因子,广泛存在于从酵母到昆虫乃至人类的多个物种中。在昆虫中,SWI/SNF复合体包括两个主要亚型——PBAP和BAP。尽管这两种复合体共享大部分亚基,但PBAP复合体特异性包含BAP170,而BAP复合体则由OSA介导。研究人员进一步发现,BAP170赋予了PBAP复合体调控生殖滞育的功能,而OSA介导的BAP复合体则不参与滞育调节。这一发现为深入理解SWI/SNF染色质重塑复合体如何介导动物季节性适应提供了新思路。
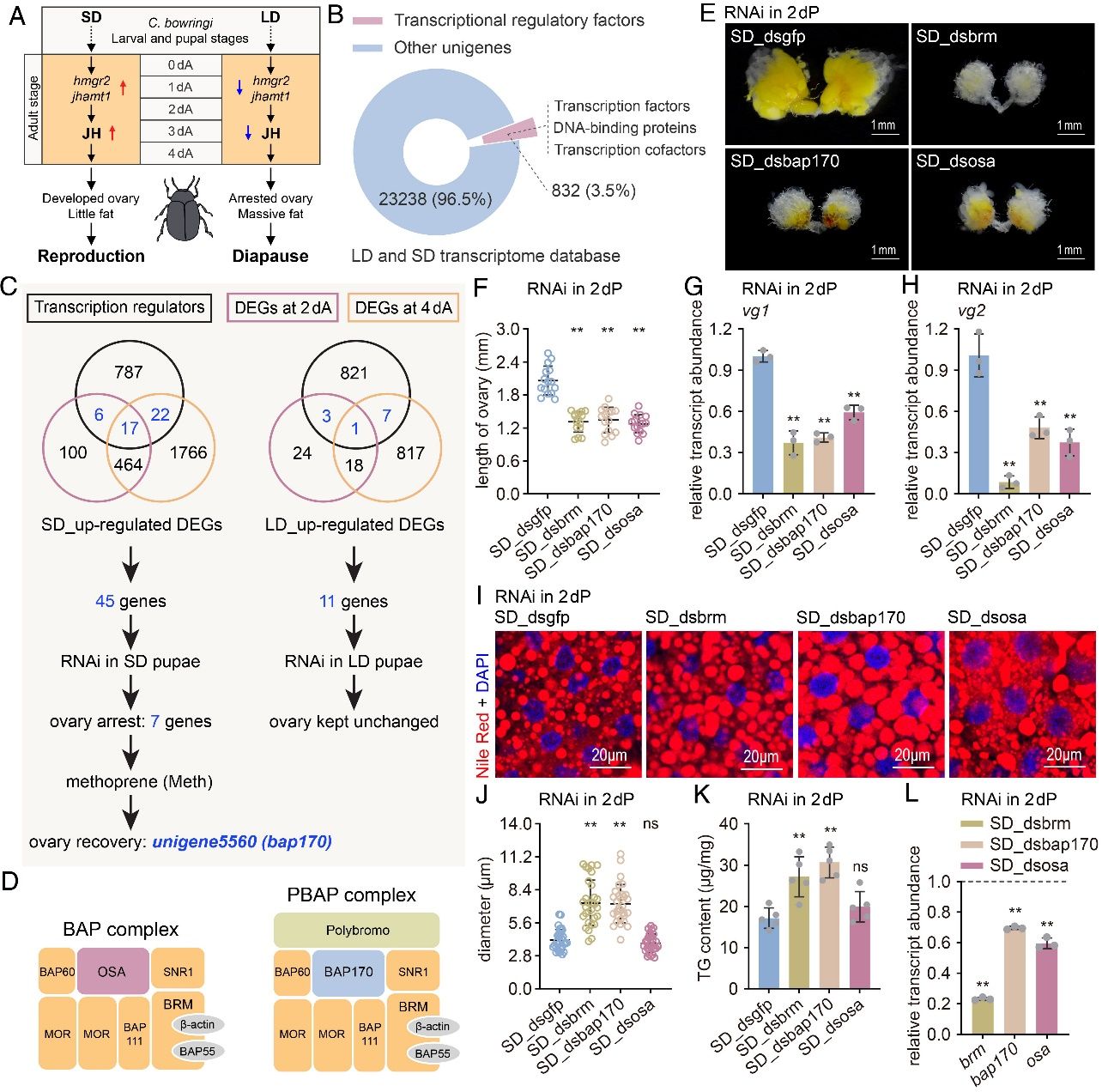
图1 RNAi筛选到bap170是大猿叶虫进入生殖滞育的关键转录调控因子
进一步的研究揭示,PBAP复合体通过SET1/COMPASS酶介导的H3K4me3修饰来调节JH合成。H3K4me3是一种组蛋白修饰标记,与基因活化相关。研究发现,在长光照条件下,PBAP复合体的活性下降,导致JH合成器官——咽侧体中H3K4me3水平降低,从而抑制JH合成,引发滞育。为进一步明确PBAP-SET1/COMPASS的下游靶标,该研究对敲低bap170后的雌虫咽侧体进行了转录组测序与分析。通过第二轮RNAi筛选,研究人员从28个候选基因中鉴定出,钙调蛋白(calmodulin,CaM)是咽侧体中PBAP-SET1/COMPASS信号的重要靶标。ChIP和激素拯救试验证实,PBAP-SET1/COMPASS通过调控cam基因上游调控区域H3K4me3的富集水平,直接影响cam的转录,从而调节JH合成,并最终决定生殖滞育的发生。
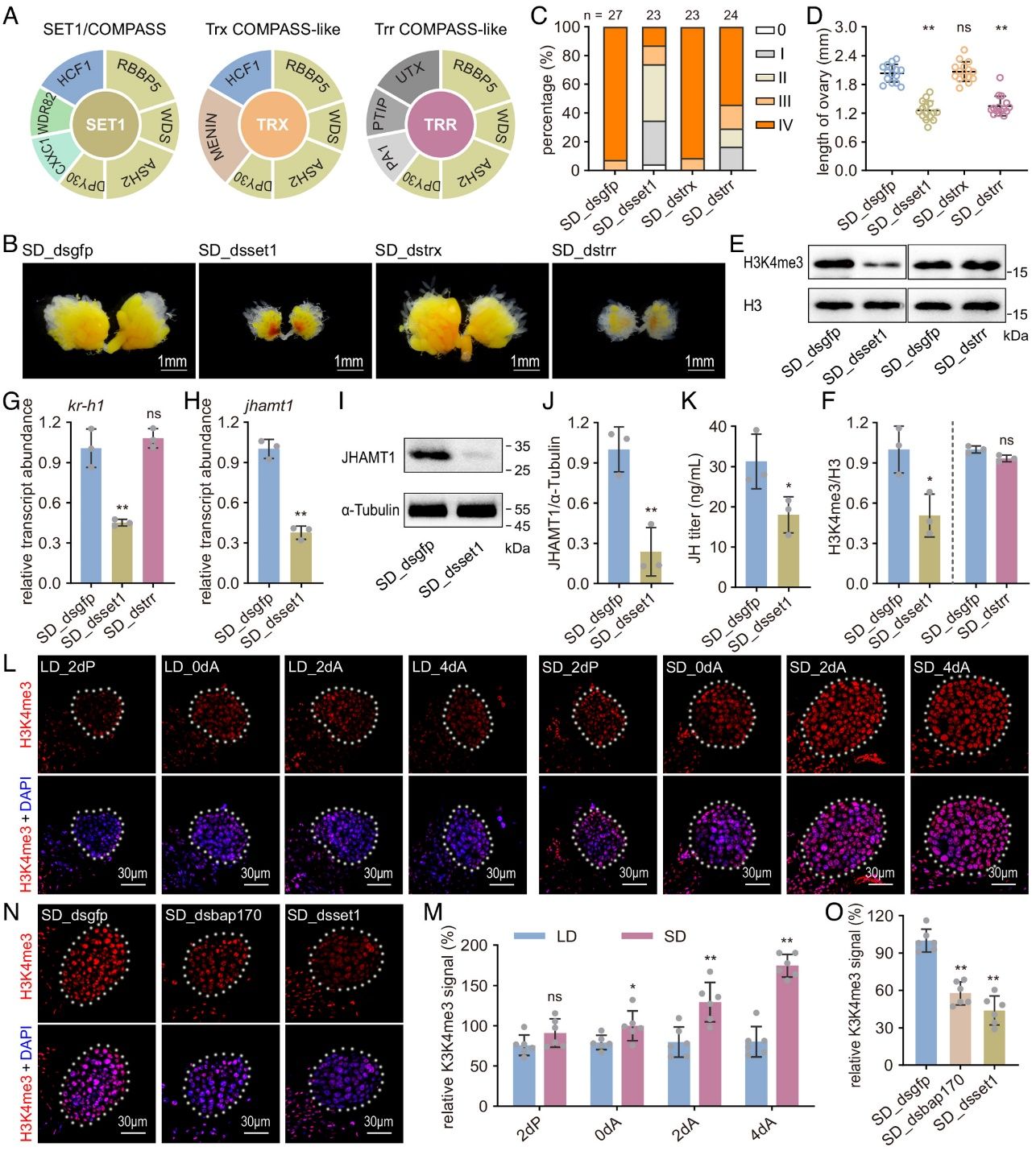
图2 bap170通过咽侧体中的SET1/COMPASS-H3K4me3信号轴调控甲虫滞育发生
综上所述,该研究构建了“光周期—染色质重塑—钙信号—保幼激素—生殖滞育”的信号轴,从内分泌控制的角度,揭示了昆虫滞育表观遗传调控的机制。该研究不仅加深了对昆虫滞育表观遗传调控机制的理解,还为基于滞育调控的害虫生态防治和昆虫资源利用技术研发提供了重要的理论支撑。
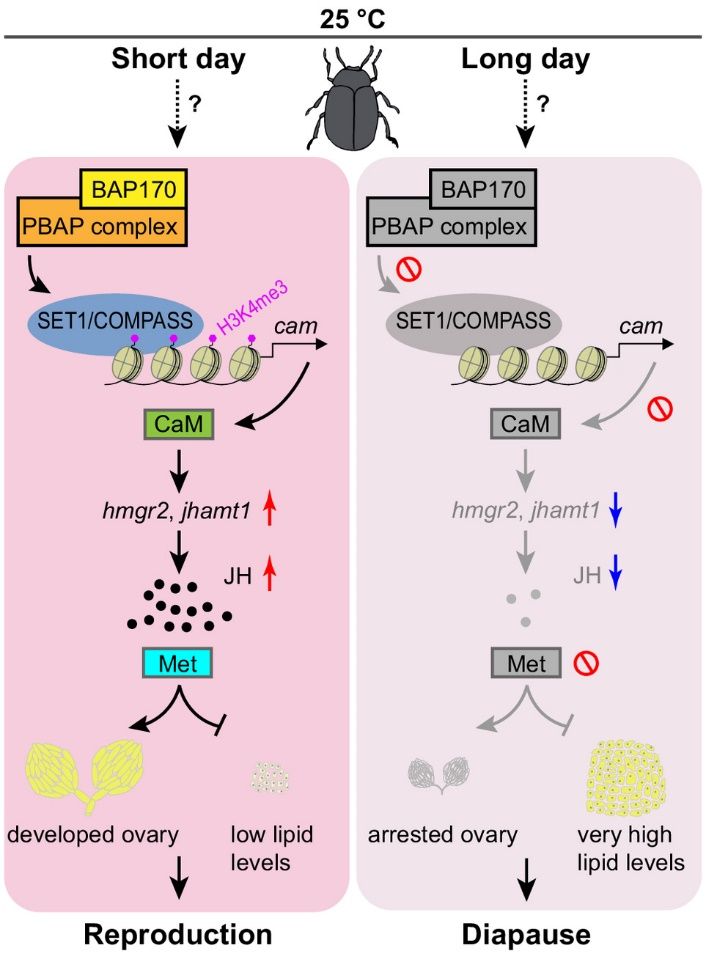
图3 PBAP染色质重塑复合体通过SET1/COMPASS和JH信号通路调控大猿叶虫生殖滞育
据悉,华中农业大学植物科学技术学院已毕业博士生田忠(现为成都中医药大学博士后)为论文第一作者,王小平教授和加拿大阿尔伯塔大学刘文博士为该论文共同通讯作者。华中农业大学在读博士生王蔻、已毕业博士生郭霜、已毕业硕士生李家旭和朱芬教授以及加拿大阿尔伯塔大学Kirst King-Jones教授为研究提供了重要支持与指导。该研究得到了国家自然科学基金以及加拿大自然科学与工程研究委员会(NSERC)等项目的资助。
审核人 王小平
【英文摘要】
Diapause, a developmental arrest mechanism, helps animals to survive seasonal changes via endocrine regulation. While obligate diapause is genetically programmed, facultative diapause is typically triggered by environmental cues such as photoperiod. In insects, this often leads to reproductive diapause characterized by reduced juvenile hormone (JH) signaling, resulting in ovarian arrest and lipid accumulation. However, the molecular link between photoperiod and hormonal control remains poorly understood. In this study, we investigated the cabbage beetle Colaphellus bowringi as our model system. This species exhibits a photoperiodic response, where short-day (SD) conditions promote reproduction, whereas long-day (LD) conditions induce diapause. Our research identified the PBAP chromatin remodeling complex as a key regulator of LD-induced summer diapause entry. Through RNAi screening of 56 transcriptional regulators that were differentially expressed between SD and LD females, we identified BAP170, a PBAP-specific component, as a key mediator of diapause. Knockdown of bap170 in SD females induced reproductive diapause traits, which were reversed by treatment with methoprene, a JH analog, suggesting that the PBAP complex regulates diapause by influencing JH production. We further demonstrated that the PBAP complex modulates JH biosynthesis via SET1/COMPASS-mediated trimethylation of H3K4. Transcriptome analysis and a second RNAi screen identified calmodulin, a calcium-binding messenger protein gene, as a direct target of PBAP-SET1/COMPASS-H3K4me3 signaling in the corpora allata (CA), the primary source of JH. These findings reveal how the chromatin remodeling machinery translates photoperiod signals into endocrine responses governing seasonal adaptation.
点击阅读论文