南湖新闻网讯(通讯员付攀)1月11日,我校农业微生物资源发掘与利用全国重点实验室、洪山实验室、生命科学技术学院益生菌智造创新团队韩文元教授课题组在Nucleic Acids Research杂志发表了题为“A mobile genetic element-derived primase-polymerase harbors multiple activities implicated in DNA replication and repair”的研究论文。文章报道了与原核生物Argonaute基因(pAgos)相关联的引物酶-聚合酶 (Primase-polymerase, PrimPol)的多重功能。这种与pAgos相关的引物酶-聚合酶 (pAgo-associated PrimPol, AgaPP) 可能编码于可移动遗传元件,具有传统的引物酶和聚合酶活性,同时与下游基因编码的解旋酶相互作用,表明它们组成了一个功能性的可移动元件复制模块。其中,AgaPP能够执行跨损伤DNA合成、末端转移以及微同源介导的末端连接(microhomology-mediated end joining, MMEJ),表现出与人类DNA修复聚合酶θ显著的相似性。同时AgaPP可以促进Cas9诱导的双链DNA断裂的MMEJ修复,并提高大肠杆菌在DNA损伤后的存活率。该研究基于AgaPP的MMEJ特性设计了体外DNA拼接的新工具,其所需的同源序列的长度显著小于传统的DNA拼接方法。
古菌-真核生物引物酶(Archaeo-Eukaryotic Primase, AEP)超家族包含一类非典型的DNA聚合酶,在古菌和真核生物发挥引物酶的功能,同时还广泛存在于古菌和细菌的可移动元件中(包括质粒、转座子、病毒等)。AEP蛋白通常与其它结构域和蛋白质融合或聚集在一起,这些特性表明这些结构域之间可能存在功能协调性。来自于可移动元件的AEP超家族成员在DNA代谢中表现出功能多样性,其功能与活性研究还相对缺乏。
研究人员在对AgaPP进行进化分析,发现整合酶、AgaPP、PriCT-DUF3987蛋白和Long-B型pAgo是基因簇中的保守成分,而其它基因则经常被获得或丢失。研究人员选择了Seonamhaeicola sp. S2-3的基因簇进行进一步分析,基因簇的另一端是一个tRNA基因,表明该区域为一个整合的可移动遗传元件。在对AgaPP进行生理生化功能解析时发现其具有多重功能(图1)。除了具有引物酶和聚合酶活性外,AgaPP还可以进行跨损伤DNA合成及提高大肠杆菌DNA损伤后的生存率,表明其可能参与DNA损伤修复。进一步的生化实验表明,AgaPP可以促进具有微同源末端的DNA进行snap-back合成及微同源末端连接,且连接效率与微同源末端的氢键数目相关。体内实验进一步表明,AgaPP的表达使得其通过微同源末端连接作用提升体内DNA双链断裂后同源末端连接修复的效率,从而提高DNA双链断裂后的修复效率。
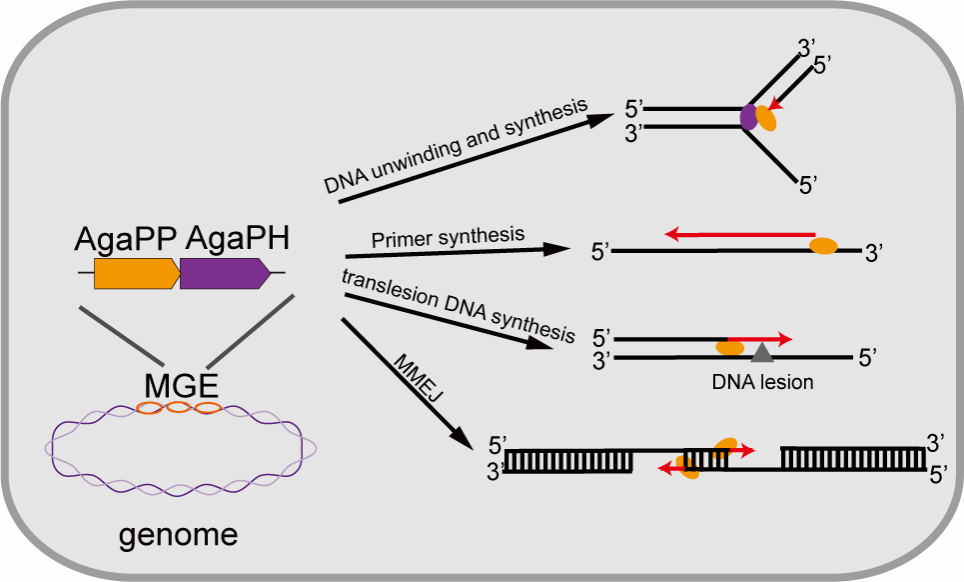
图1 AgaPP的多功能示意图。
此外,该研究基于AgaPP的微同源末端连接作用改进了基于同源序列的体外DNA拼接方法。即介导两条末端含有同源的3’突出序列的DNA分子退火,并以一条3’突出序列为模板、另一条3’突出序列为引物催化DNA合成,以此实现DNA分子的拼接。这一种MMEJ辅助的DNA组装方法,命名为MEDA组装(MMEJ-assisted DNA Assembly),可应用于DNA克隆中(图2)。该方法使得DNA组装能够在更短的同源序列下进行,反应体系简单、低成本、操作便捷快速,适合大规模推广使用。
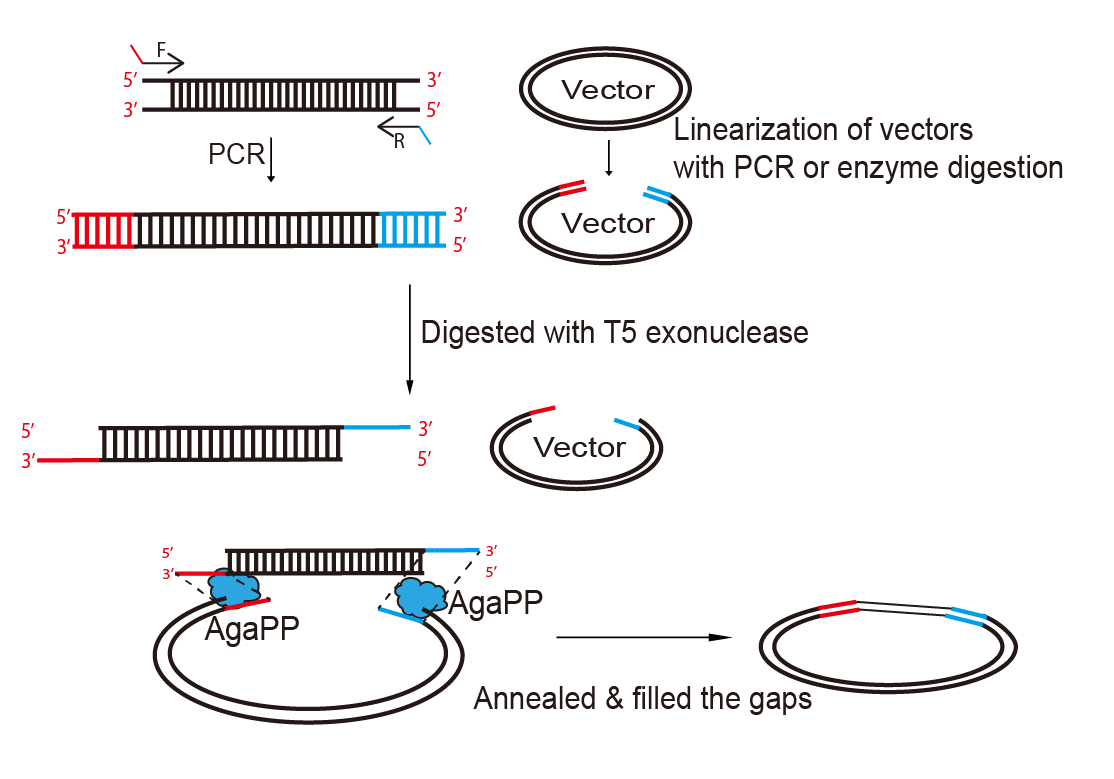
图2 AgaPP在体外协助DNA组装
生命科学技术学院已出站博士后付攀为文章的第一作者,韩文元教授为通讯作者,课题组多名硕士生、本科生参与了研究。本研究得到了国家重点研发计划、国家自然科学基金、洪山实验室基金等项目的支持。
文章链接:https://doi.org/10.1093/nar/gkae1318
审核:韩文元