南湖新闻网讯(通讯员 尚均忠 何超超)近日,果蔬园艺作物种质创新与利用全国重点实验室、园艺林学学院宁国贵教授课题组在The Plant Cell上发表了题为“Boosting transcriptional activities by employing repeated activation domains in transcription factors”的研究论文。该研究首次在全球范围内提出了一种创新方法,通过串联重复天然转录因子的转录激活结构域(ADs)显著增强转录因子的转录激活活性。这一策略具有广泛的适用性,能够适用于不同转录因子家族,并成功应用于包括玫瑰、草莓、番茄和矮牵牛在内的多个重要园艺作物的种质创新,成功培育出了富含高色素的优质新种质。
基因表达调控在维持细胞代谢稳态和调控生长发育过程中具有至关重要的作用(Levine & Tjian, 2003)。转录因子(TFs)是基因表达调控的核心调节因子,通常由DNA结合结构域(DBD)和转录激活结构域(AD)组成。通过结合靶基因的启动子,转录因子能够招募并激活转录复合体,从而启动并精确调控基因表达。DBDs在同源蛋白中通常表现出较高的结构保守性,而ADs则通常位于蛋白质的内在无序区域,展现出较大的结构和功能灵活性(Brodsky et al., 2021)。大量研究表明,转录因子广泛参与调控作物的重要农艺性状和品质性状。因此,提升转录因子的转录激活活性对于生物改良、代谢工程和植物科学研究具有重要意义。操控转录因子的转录激活能力不仅有助于深入解析其功能机制,还能够在系统和合成层面上推动植物基因工程的进步。然而,迄今为止,世界上尚未有研究通过优化天然转录因子的ADs来合成具有更强转录激活活性的人工转录因子,这一领域仍待进一步探索。
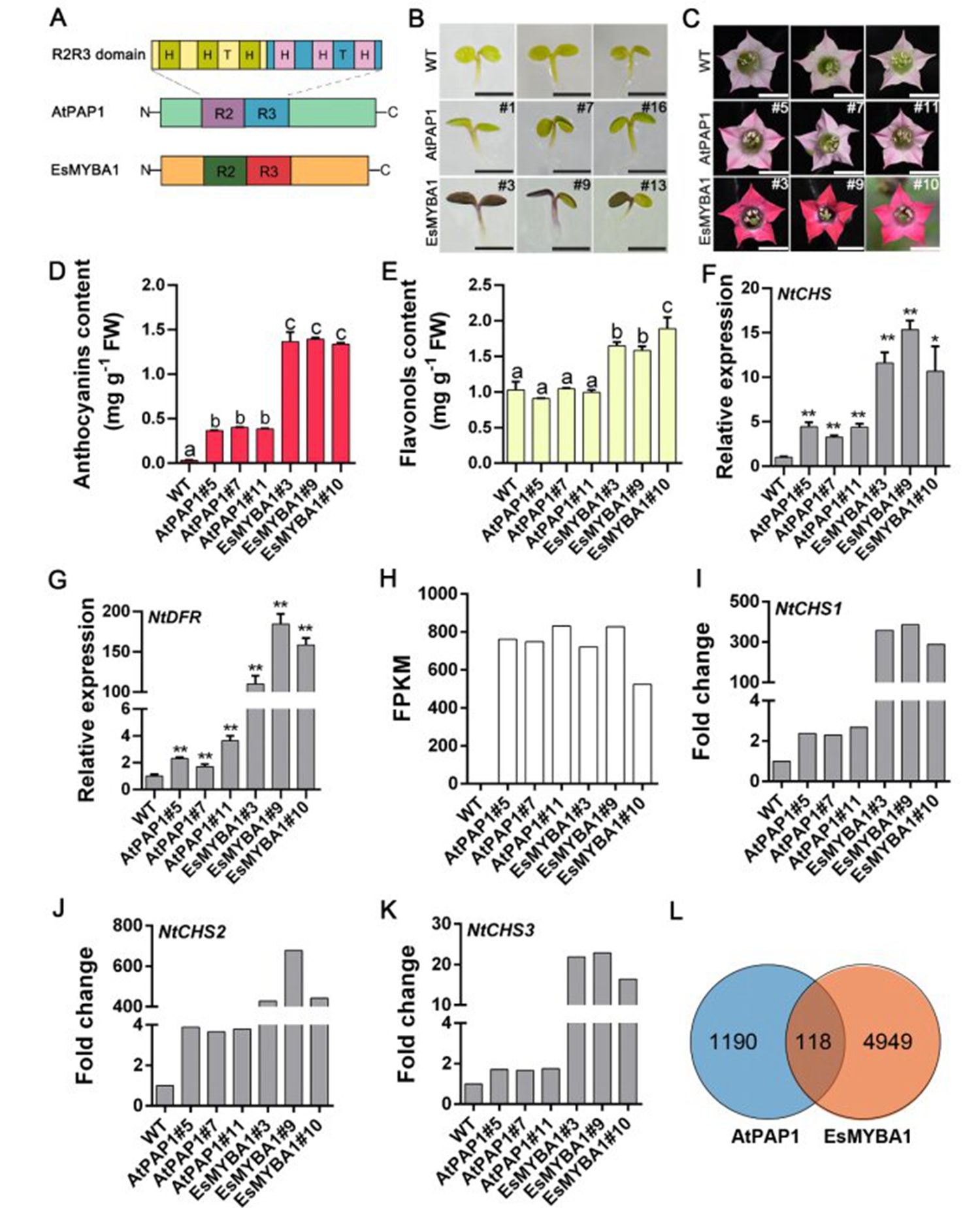
图1 MYB转录因子调控花青素生物合成
研究团队首先以两个调控花青素生物合成的R2R3-MYB类转录因子为研究对象,分别是来源于拟南芥(Arabidopsis thaliana)的AtPAP1和来源于淫羊藿(Epimedium sagittatum)的EsMYBA1。通过过表达拟南芥和烟草,发现相较于AtPAP1,在过表达EsMYBA1的株系中花青素的合成与积累显著提高。此外,EsMYBA1在下游类黄酮合成关键基因的转录水平上表现出更强的调控能力。通过RNA-seq分析进一步证实,EsMYBA1对共同的下游基因具有显著更高的转录激活活性,这表明同源MYB基因之间在转录激活强度方面存在显著差异。
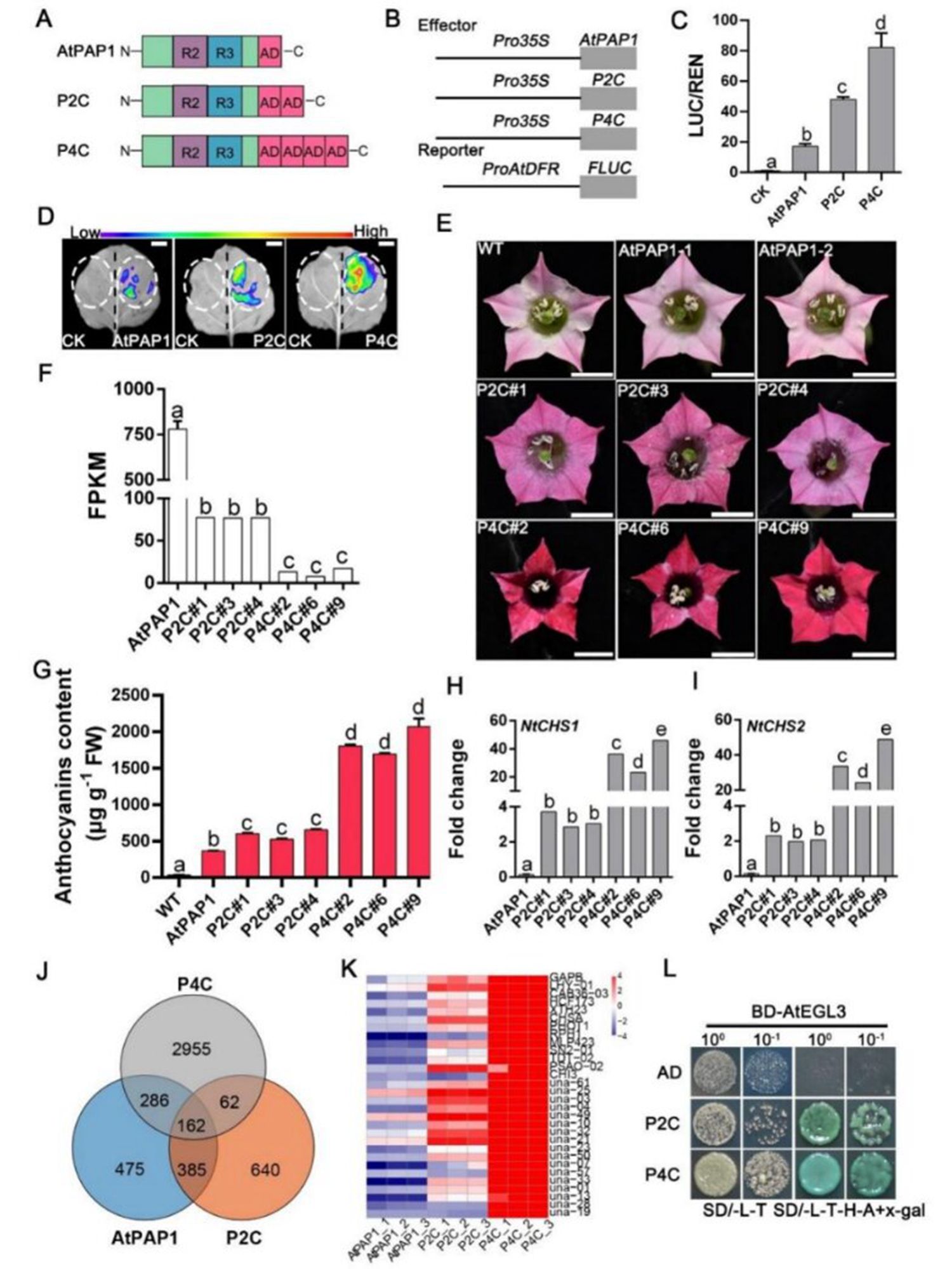
图2串联重复AtPAP1的ADs合成转录因子的功能分析
紧接着,研究团队采用了多种策略,包括替换转录因子的DBDs和ADs、串联重复转录因子的DBDs以及串联重复转录因子的ADs,合成了一系列工程化转录因子。通过遗传转化实验,发现串联重复ADs显著促进了烟草植物中花青素的积累,并显著提高了类黄酮合成相关基因的表达水平,表明串联重复ADs能够有效增强转录因子的转录激活活性。进一步的研究还表明,来自NAC、bHLH和EIL转录因子家族成员的工程化转录因子在转录激活能力上显著优于天然转录因子。这些研究成果深化了我们对转录因子转录激活机制的理解,并表明通过串联重复天然转录因子的ADs,是一种具有广泛适用性的有效策略,能够显著提升转录因子的转录激活能力。

图3创制园艺作物(玫瑰、草莓、矮牵牛、番茄)新种质
综上所述我们提供了一种有效的方法,该方法能够显著增强转录因子(TFs)的转录激活活性,同时对下游基因的潜在不良影响降至最小,同时利用该方法创制了一系列园艺作物新种质。随着对关键转录因子的持续深入挖掘,这一增强转录因子活性的策略不仅为揭示转录激活效能的分子机制提供了重要视角,而且将在基础研究、合成生物学、基因工程及基因治疗等领域的应用中展现出日益重要的价值,推动相关科学进展。
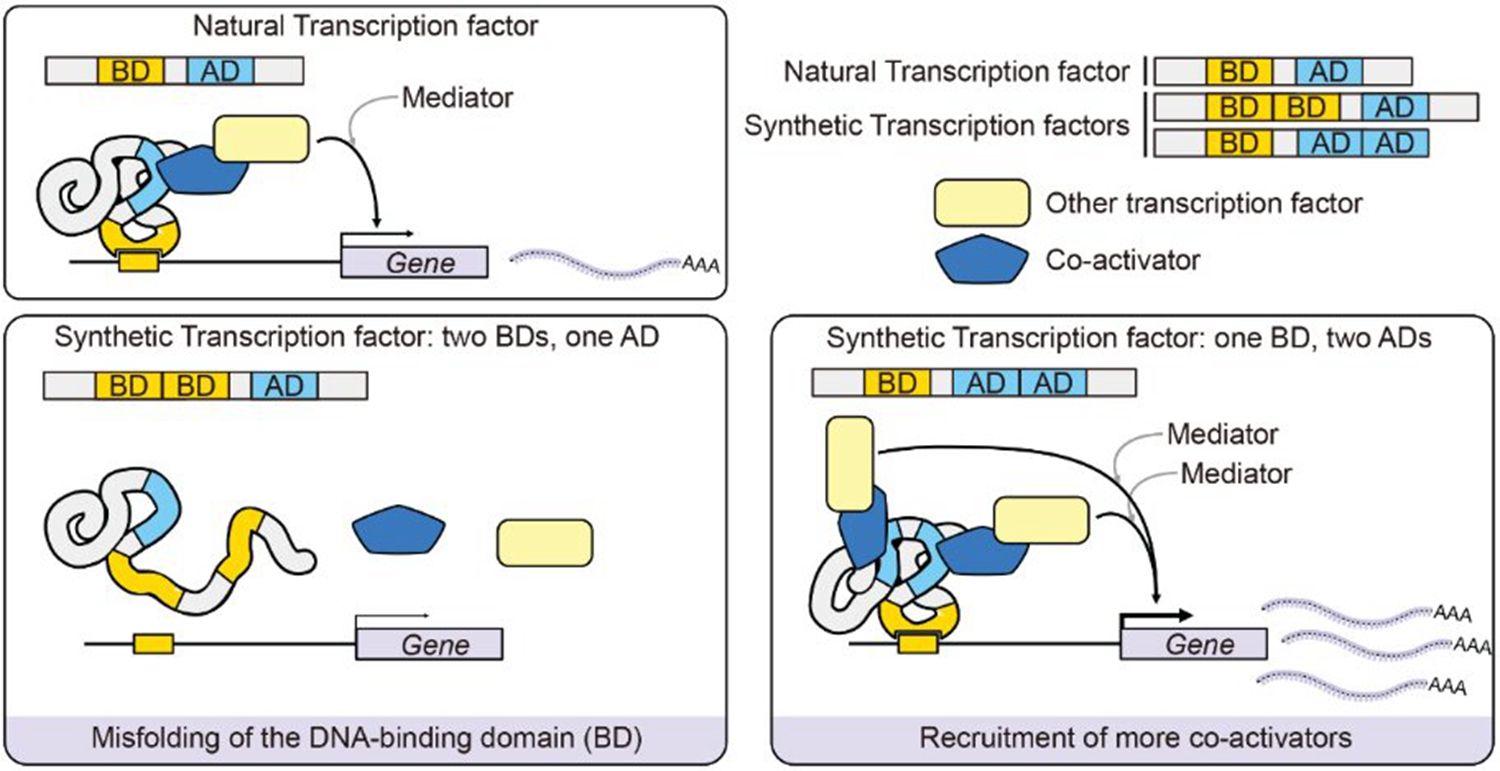
图4提高转录因子转录激活活性的策略示意图
华中农业大学园艺林学学院宁国贵教授为该论文的通讯作者,华中农业大学何超超博士(现为浙江省农科院博士后)、梁跃博士后(现为中国农业大学副教授)和陈润洲博士为该文共同第一作者,华中农业大学博士生李润慧,已毕业硕士研究生孙婷婷、杜星、倪晓梅,已毕业博士研究生申玉晓(现就职于河南农业大学),华中农业大学尚均忠副研究员,华中农业大学何燕红副教授,华中农业大学包满珠教授,克莱姆森大学罗宏教授,云南省农科院王继华研究员,香港浸会大学廖攀教授,华中农业大学康春颖教授,康涅狄格大学袁耀武教授也参与了本研究工作。本研究得到了国家重点研发计划项目(No: 2022YFF1003100, 20119YFD1000400)、国家自然科学基金(32202528)和现代农业产业技术体系建设(CRAS-23)的支持。
【英文摘要】
Enhancing the transcriptional activation activity of transcription factors (TFs) has multiple applications in organism improvement, metabolic engineering, and other aspects of plant science, but the approaches remain unclear. Here, we used gene activation assays and genetic transformation to investigate the transcriptional activities of two MYB TFs, PRODUCTION OF ANTHOCYANIN PIGMENT 1 (AtPAP1) from Arabidopsis (Arabidopsis thaliana) and EsMYBA1 from Epimedium (Epimedium sagittatum), and their synthetic variants in a range of plant species from several families. Using anthocyanin biosynthesis as a convenient readout, we discovered that homologous naturally occurring TFs showed differences in the transcriptional activation ability and that similar TFs induced large changes in the genetic program when heterologously expressed in different species. In some cases, shuffling the DNA binding domains and transcriptional activation domains (ADs) between homologous TFs led to synthetic TFs that had stronger activation potency than the original TFs. More importantly, synthetic TFs derived from MYB, NAC, bHLH, and Ethylene-insensitive3-like (EIL) family members containing tandemly repeated ADs had greatly enhanced activity compared to their natural counterparts. These findings enhance our understanding of TF activity and demonstrate that employing tandemly repeated ADs from natural TFs is a simple and widely applicable strategy to enhance the activation potency of synthetic TFs.
点击阅读原文
审核人 宁国贵