南湖新闻网讯(通讯员邢雨生)2024年7月26日,我校生物医学与健康学院、生命科学技术学院、湖北洪山实验室张晓妍课题组于国际学术期刊Autophagy在线发表了题为“GORASP2 promotes phagophore closure and autophagosome maturation into autolysosomes”的研究论文。该论文揭示了高尔基体结构蛋白响应外界压力参与自噬的分子机制,为细胞应对环境变化,以及细胞内膜系统细胞器之间的互作和动态调控机制给与新的启示。

高尔基体是细胞内物质运输系统中处于中心位置的膜状细胞器,最为熟知的功能是对来自内质网的物质进行加工和运输。近期的研究发现,高尔基体在细胞内还扮演更多角色。例如,在接受外界刺激或在病理条件下,其结构与功能都能做出应激反应,因此高尔基体可以作为信号中转站。但高尔基体应对外界多变环境的分子机制尚不清楚。
张晓妍团队在前期的工作中发现,维持高尔基体扁平膜囊堆叠结构的GORASP2,能够通过其O-GlcNAc糖基化修饰水平感受外界刺激。不能被糖基化修饰的GORASP2可定位于自噬体上参与葡萄糖缺乏引起的细胞自噬。本研究延续之前的工作,致力于解析GORASP2参与自噬的分子机制。
通过超分辨显微镜及多种生化分析,本研究发现GORASP2在葡萄糖饥饿条件下定位于自噬体表面,通过调控VPS4A和ESCRT-III蛋白互作促进自噬体闭合。在自噬体闭合后,GORASP2还参与自噬体与溶酶体的融合,进而完成货物降解。在自噬体-溶酶体融合过程中,GORASP2通过调控自噬体上UVRAG复合物的组装影响PI3P产生,从而调控GTPase RAB7A的GEF活性,继而影响膜栓系因子HOPS与RAB7A的互作。此外,GORASP2缺失可导致STX17-SNAP29-VAMP8,YKT6-SNAP29-STX7两对SNARE的组装受损,最终损伤自噬体与溶酶体的融合过程。
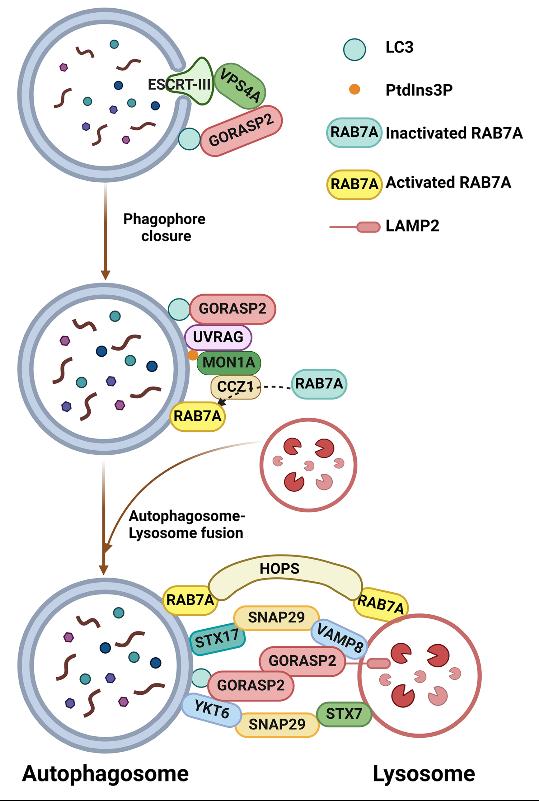
GORASP2参与自噬的分子机制模式图
通过解析GORASP2参与自噬体闭合,以及在自噬体-溶酶体融合中与经典的RAB7A-HOPS-SNAREs膜融合机器之间的关系,揭示了高尔基体结构蛋白在不同外界刺激条件下的功能变化,阐释了高尔基体与自噬体膜之间沟通与联系的分子机制。
华中农业大学生物医学与健康学院、生命科学技术学院、湖北洪山实验室张晓妍教授为该论文的通讯作者,博士研究生邢雨生为该论文的第一作者。深圳湾实验室王彦庄教授为论文提供了指导。该研究得到了华中农业大学生物医学与健康学院、农业微生物资源发掘与利用全国重点实验室公共技术平台的支撑。该研究得到了国家自然科学基金委资助。
审核:张晓妍