南湖新闻网讯(通讯员 闫旭)近日,PNAS在线发表了华中农业大学园艺林学学院、果蔬园艺作物种质创新与利用全国重点实验包满珠团队和佛罗里达大学Douglas E. Soltis团队合作的题为“Genome evolution of the ancient hexaploid Platanus × acerifolia (London planetree)”的研究论文。研究报告了二球悬铃木(Platanus × acerifolia)高质量基因组,发现二球悬铃木是古六倍体,由三套高度共线性的亚基因组组成,并创新的利用低拷贝同源基因的系统发育拓扑结构区分三套亚基因组。
全基因组加倍(WGD; Whole-Genome Duplications)及随后的基因组重排(genome shuffling)是物种演化的重要驱动力。过去基因组学研究表明多数现存真双子叶植物,如荷花、葡萄、拟南芥等,与具有七条染色体的真双子叶植物重构祖先相比经历了广泛的基因组重排。然而基因组重排会导致生殖隔离,给生物带来机遇的同时也对物种的存续带来的巨大挑战。是否存在古多倍体物种在全基因组加倍后,只经历较少基因组重排便可演化成功?基因组重排较少的物种其全基因组加倍后产生的重复基因有何保留与丢失模式?悬铃木属是悬铃木科唯一的现存成员,属于核心真双子叶的姐妹类群(真双子叶基部类群),在开花植物的演化中占有关键的系统发育位置,为研究真双子叶植物谱系进化提供了绝佳的切入点。同时悬铃木成为世界上最重要的行道树种之一,全球产业和生态价值达数十亿美元, 具有很高的产业价值。
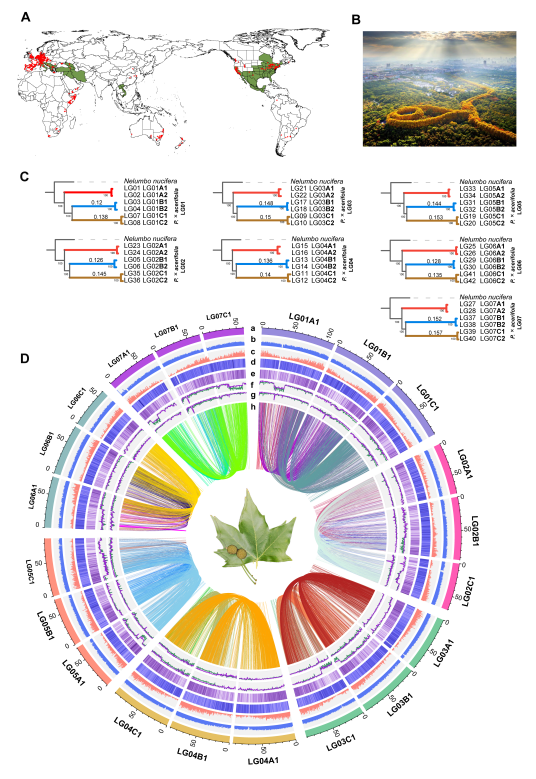
二球悬铃木基因组及分型
基因组演化研究结果表明,悬铃木不与其他双子叶植物共享全基因组加倍事件,其基因组核型来自于悬铃木科独有的两次连续古全基因组加倍事件,导致其形成三个亚基因组并保留至今。
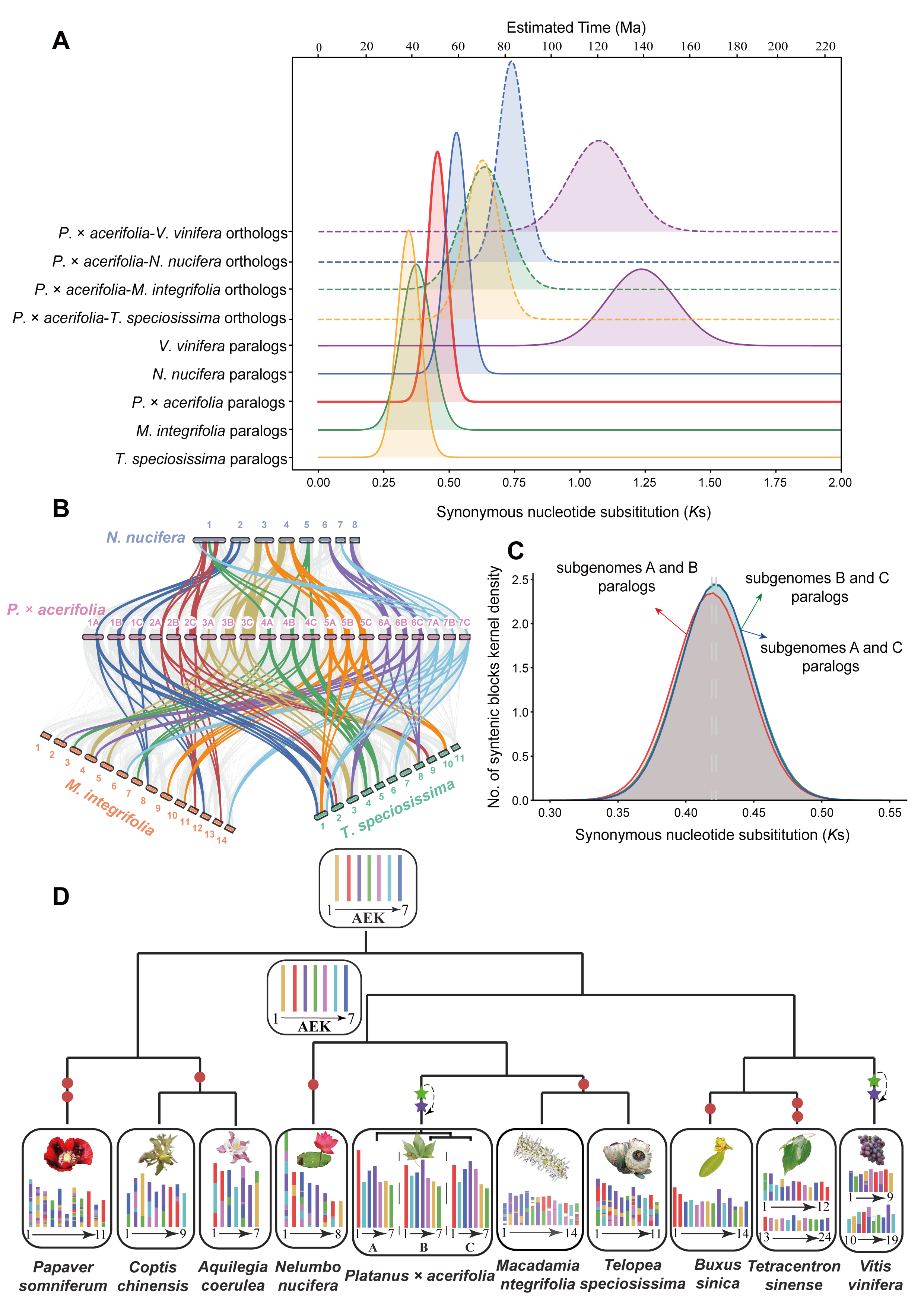
悬铃木特有的两次古全基因组加倍事件
与经历全基因组加倍和随后基因组重排的其他物种不同,二球悬铃木是目前经历最少基因组重排的古多倍体物种,并表现出核型停滞现象,每一条染色体均仅遗传自双子叶祖先的单一染色体。
二球悬铃木在基因表达、同源基因构成、转座子分布特征、核酸多态性、共线性基因对层面未检测到亚基因组优势。基因表达趋势分析显示悬铃木全基因组加倍复制的基因拷贝表现出广泛的亚功能化/新功能化。
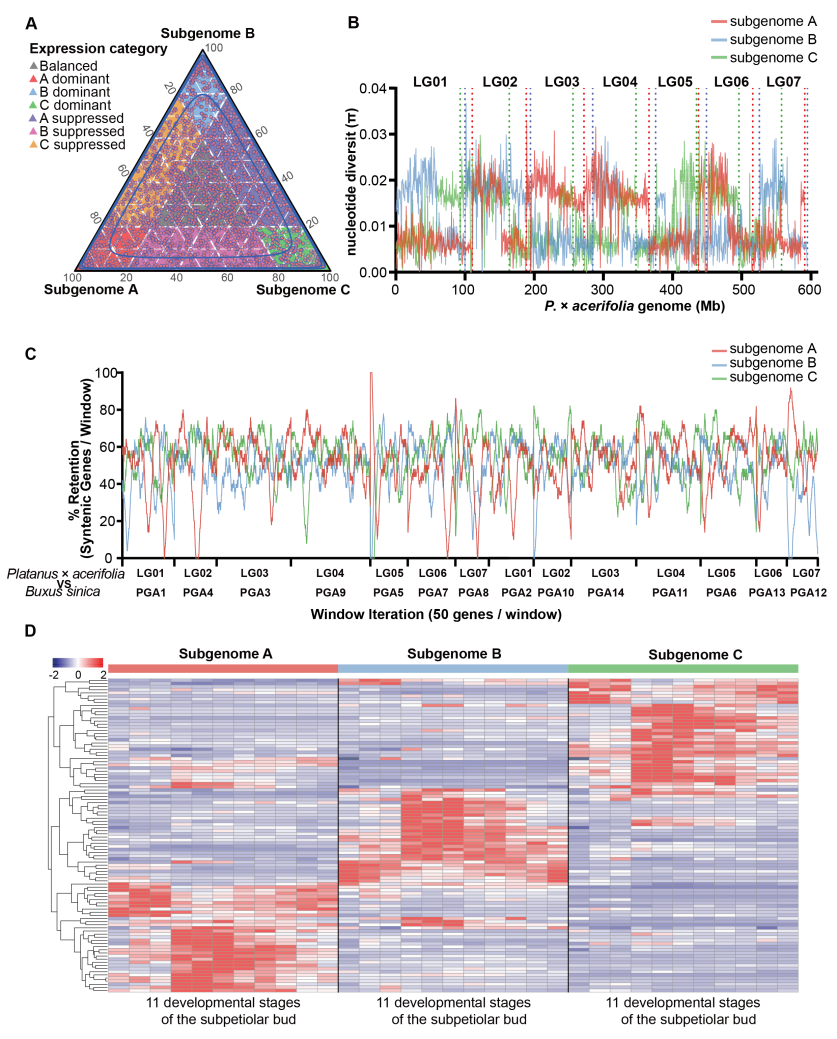
二球悬铃木表现出广泛的亚功能化/新功能化,但未检测到亚基因组优势
二球悬铃木具有独特的成花转变历程,其在在第一年形成柄下芽并休眠,在第二年开花。二球悬铃木与其他真双子叶基部类群植物相比,其多数开花时间基因主要通过WGD事件导致拷贝数量发生显著扩张。少数开花时间基因如SOC1也表现出串联重复事件与WGD事件共同显著贡献了基因拷贝数量的增加。还发现了开花时间调控基因簇现象,如SOC1与BFT在全基因组加倍之前就形成了基因簇。转录组分析显示二球悬铃木开花时间基因的拷贝数扩张伴随着广泛的亚/新功能化表达趋势。其中悬铃木PaBBX28/29不同拷贝的实验显示短日照条件下PaBBX28/29-2拷贝的异源转化可推迟拟南芥的开花时间,而PaBBX28/29-1拷贝不具有相同功能。以上研究结果表明二球悬铃木开花时间基因的拷贝数增加及随后的亚功能化/新功能化可能为二球悬铃木独特的开花特征提供了遗传基础。
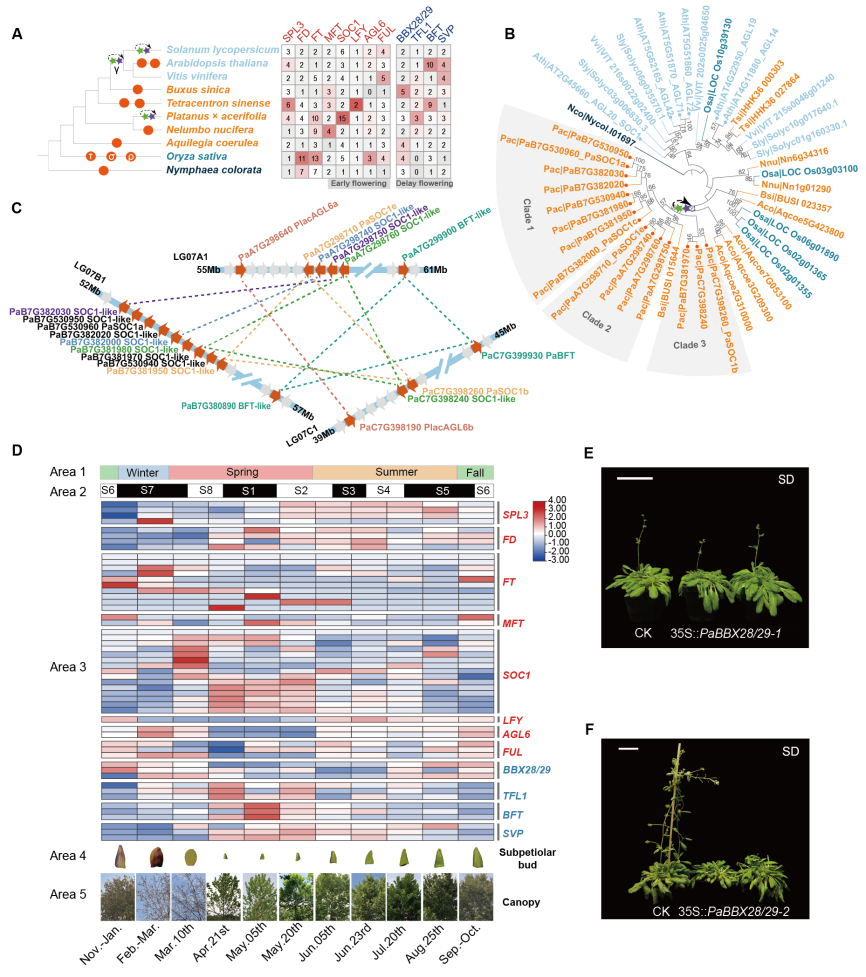
二球悬铃木开花时间基因的扩张与亚功能化/新功能化
包满珠教授团队长期从事悬铃木种质创新与少球、无球新品种培育研究,已经获得国家新品种权11个,其中少球品种8个,无球品种3个,目前正在全国范围内推广示范。此文是对悬铃木开花、结果及少球无球性状机理解析的一部分。华中业大学已经毕业博士研究生闫旭(现为上海交通大学博士后),已经毕业博士研究生石戈辉、华中农业大学孙苗教授、美国佛罗里达大学博士后单圣臣为该论文的共同第一作者,华中农业大学包满珠、宁国贵、张佳琪和美国佛罗里达大学Douglas E. Soltis为论文的通讯作者。研究团队成员Pamela S. Soltis(美国佛罗里达大学)、刘仲健(福建农林大学)、胡永红(上海辰山植物园)参与了该项研究。
审核人:包满珠
【英文摘要】
Whole-genome duplication (WGD; i.e., polyploidy) and chromosomal rearrangement (i.e., genome shuffling) significantly influence genome structure and organization. Many polyploids show extensive genome shuffling relative to their pre-WGD ancestors. No reference genome is currently available for Platanaceae (Proteales), one of the sister groups to the core eudicots. Moreover, Platanus × acerifolia (London planetree; Platanaceae) is a widely used street tree. Given the pivotal phylogenetic position of Platanus and its 2-y flowering transition, understanding its flowering-time regulatory mechanism has significant evolutionary implications; however, the impact of Platanus genome evolution on flowering-time genes remains unknown. Here, we assembled a high-quality, chromosome-level reference genome for P. × acerifolia using a phylogeny-based subgenome phasing method. Comparative genomic analyses revealed that P. × acerifolia (2n = 42) is an ancient hexaploid with three subgenomes resulting from two sequential WGD events; Platanus does not seem to share any WGD with other Proteales or with core eudicots. Each P. × acerifolia subgenome is highly similar in structure and content to the reconstructed pre-WGD ancestral eudicot genome without chromosomal rearrangements. The P. × acerifolia genome exhibits karyotypic stasis and gene sub-/neo-functionalization and lacks subgenome dominance. The copy number of flowering-time genes in P. × acerifolia has undergone an expansion compared to other noncore eudicots, mainly via the WGD events. Sub-/neo-functionalization of duplicated genes provided the genetic basis underlying the unique flowering-time regulation in P. × acerifolia. The P. × acerifolia reference genome will greatly expand understanding of the evolution of genome organization, genetic diversity, and flowering-time regulation in angiosperms.
论文链接:https://www.pnas.org/doi/10.1073/pnas.2319679121