南湖新闻网讯(通讯员 陈玉)11月30日,Trends in Microbiology杂志在线发表了我校农业微生物学国家重点实验室和生命科学技术学院、湖北省洪山实验室韩文元课题组关于CRISPR-Cas系统和原核Argonaute(Ago)系统新作用范式的综述文章“The abortive infection functions of CRISPR-Cas and Argonaute”。文章总结了CRISPR-Cas系统和原核Ago系统通过流产感染(abortive infection)提供免疫保护的各种机制,提出了这种免疫范式的统一模型,并对本领域下一步的研究作出展望。
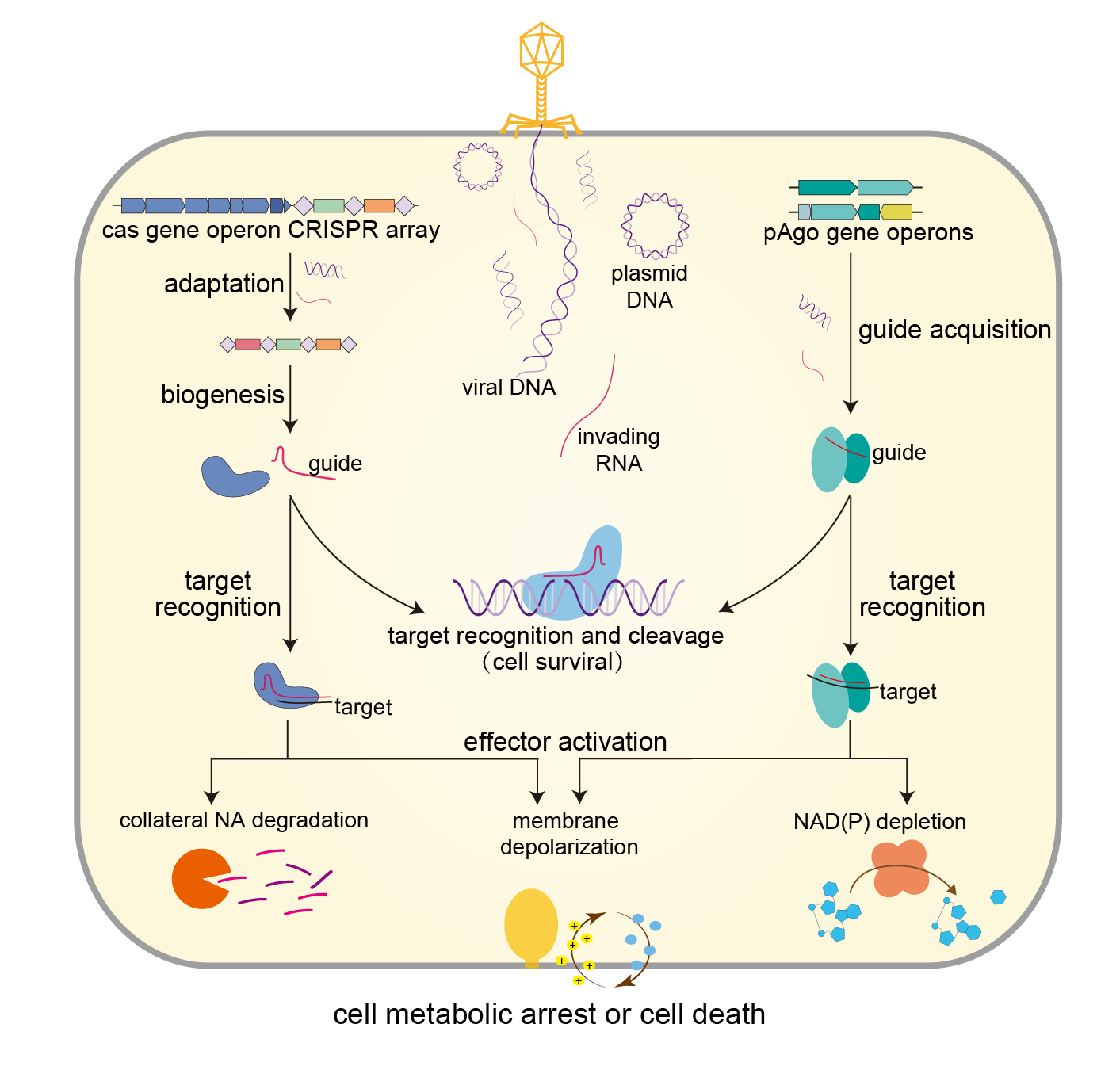
图1 CRISPR-Cas和原核Ago系统的作用模式
CRISPR-Cas和原核Ago由于核酸介导的序列特异性核酸切割这一特征受到广泛关注。正是基于这一特征,它们被开发为基因编辑和其它序列特异性的分子工具。在它们的天然宿主中,这种活性可以切割外源核酸,从而抵御病毒等可移动元件的入侵。2011年,科学家初步确立了CRISPR-Cas系统的工作模式(图1),并提出了“三步”经典模型:(1)适应,CRISPR-Cas系统获得一小段外源核酸,并将其插入到CRISPR阵列中;(2)表达,CRISPR阵列的转录与转录本的处理产生CRISPR RNA(crRNA),即向导(guide);(3)干扰,crRNA与Cas蛋白形成复合体,然后介导后者识别并切割与guide互补的外源核酸,即靶标(target)。2017年,部分原核Ago蛋白的工作机制初步得到研究,这些原核Ago能直接从外源核酸获取向导,然后在向导的介导下识别并切割靶标,从而发挥免疫功能。
然而,近年来,国内外多个课题组共同揭示了CRISPR-Cas系统和原核Ago系统的另一免疫范式,即流产感染。流产感染是一种杀死被感染细胞或造成细胞休眠,从而阻断病毒增殖并保护细胞群体的免疫策略。研究发现,III型、VI型、部分V型CRISPR-Cas系统和短型Ago系统能够介导流产感染。在这种流产感染响应中,关键之处仍然是向导介导下的靶标(外源核酸)识别,但这种识别并不导致靶标的切割或者靶标的切割不提供主要的免疫保护。相反,靶标的识别能够激活毒性效应蛋白,从而杀死被感染细胞或造成细胞休眠。目前已研究的效应蛋白包括核酸酶、NAD降解酶、蛋白酶、跨膜蛋白、转录因子等。有趣的是,这些效应蛋白往往编码于CRISPR-Cas和原核Ago的毗邻基因,因此科学家通过关联基因分析预测了更多的效应蛋白,也预示更多介导流产感染的CRISPR-Cas和原核Ago系统有待研究。
介导流产感染的CRISPR-Cas和原核Ago系统在微生物与病毒的“军备竞赛”中发挥重要作用。它们能降低病毒逃逸的几率,允许宿主获得有利的遗传元件,也能与其它免疫系统协同发挥作用,更高效地抵御病毒入侵。
另外,它们的效应蛋白具有极高的多样性,可能有各种各样特殊的活性。因此对这类系统的挖掘与鉴定也为开发更多序列特异性的分子工具打开了新的大门。
生命科学技术学院博士研究生陈玉为本文的第一作者,韩文元教授为通讯作者,生命科学技术学院博士研究生曾志锋,山东大学佘群新教授参与了部分工作。本研究得到了国家自然科学基金、国家重点研发计划、洪山实验室基金等项目的支持。
【英文摘要】
CRISPR-Cas and prokaryotic Argonaute (pAgo) are nucleic acid (NA)-guided defense systems that protect prokaryotes against the invasion of mobile genetic elements. Previous studies established that they are directed by NA fragments (guides) to recognize invading complementary NA (targets), and that they cleave the targets to silence the invaders. Nevertheless, growing evidence indicates that many CRISPR-Cas and pAgo systems exploit the abortive infection (Abi) strategy to confer immunity. The CRISPR-Cas and pAgo Abi systems typically sense invaders using the NA recognition ability and activate various toxic effectors to kill the infected cells to prevent the invaders from spreading. This review summarizes the diverse mechanisms of these CRISPR-Cas and pAgo systems, and highlights their critical roles in the arms race between microbes and invaders.
论文链接:https://www.sciencedirect.com/science/article/pii/S0966842X22003134
审核人:韩文元
