南湖新闻网讯(通讯员 吴阳)近日,我校理学院韩鹤友教授团队在纳米疫苗免疫治疗细菌性肺炎研究上获进展,相关成果以“Enhancing antibacterial immunotherapy for bacterial pneumonia via nanovaccines coated with outer membrane vesicles”为题在Chemical Engineering Journal杂志上在线发表。
抗生素的过度使用已成为当前全世界面临的严峻公共卫生问题,而疫苗是抗细菌或病毒感染最为经济有效的方式。多数细菌在整个生命周期中会分泌外膜囊泡(OMV),它们具有不可复制的双层结构,并含有大量毒力相关蛋白,可以用作潜在的细菌疫苗候选抗原。
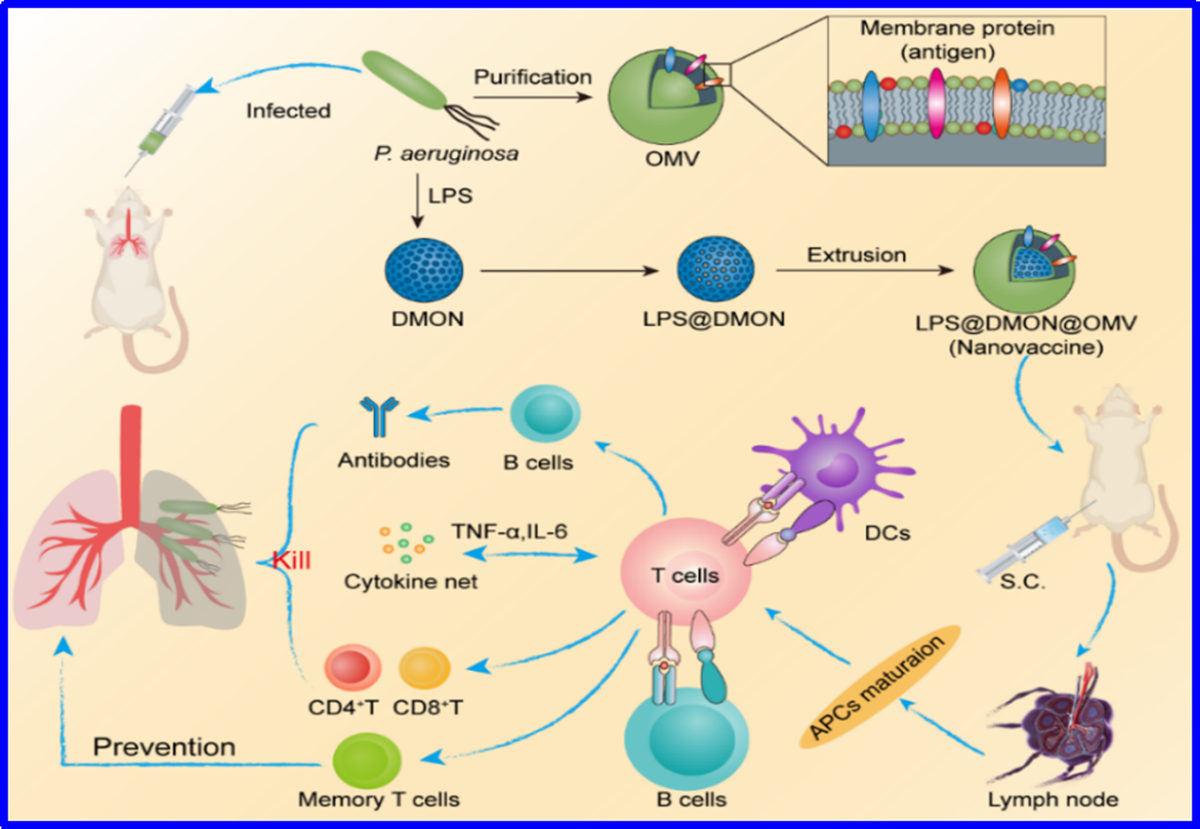
图1细菌外膜囊泡包裹的纳米疫苗调控抗菌免疫的示意图
韩鹤友教授团队巧妙地利用细菌分泌的外膜囊泡制备了一种纳米疫苗,通过刺激机体免疫反应治疗铜绿假单胞杆菌(P. aeruginosa)感染的细菌性肺炎。如图1所示,为了引起足够的抗原特异性免疫,研究采用树枝状介孔有机硅纳米颗粒(DMON)为载体负载适量佐剂脂多糖(LPS),并在外层包裹OMV抗原,合成了一种具有良好生物相容性的纳米疫苗。将此纳米疫苗注射到小鼠体内后,可快速被树突状细胞(DC)捕获并交叉呈递到淋巴结内,并刺激DC成熟;成熟DC表面的组织相容性复合体I(MHC-I)可识别CD8 T细胞引起细胞免疫;同时,成熟DC表面的MHC-II又可被辅助T细胞识别,引发后续的体液免疫,最终通过细胞免疫和体液免疫实现对肺炎的免疫治疗。更为重要的是,纳米疫苗在免疫过程中形成的记忆细胞可有效预防细菌的二次感染。
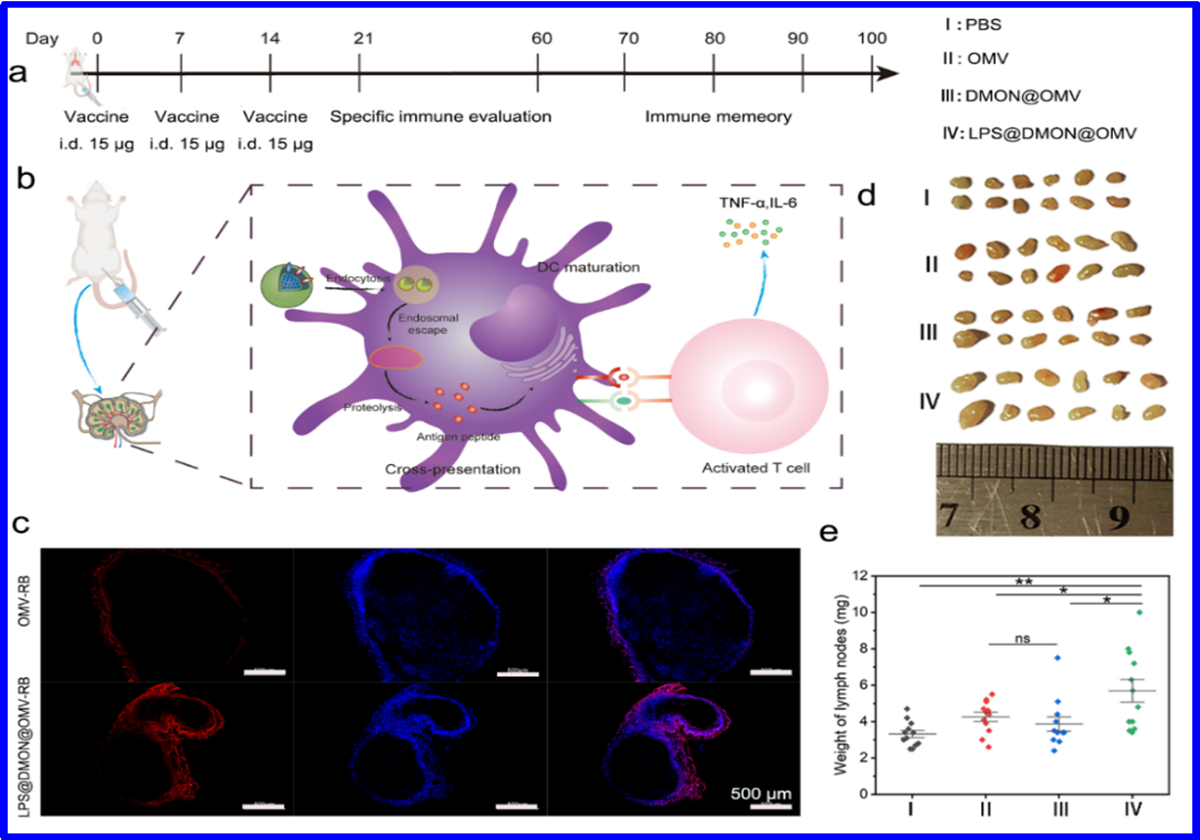
图2 LPS@DMON@OMV纳米疫苗的活体免疫评价
如图2 所示,活体实验表明,纳米疫苗在三维空间上更有利于被DC内化保证足够的抗原摄入,通过交叉呈递能够与T细胞表面的TCR进行相互作用,并配合辅助分子的相互作用激活T细胞(图1和图2b)。小鼠三次接种纳米疫苗后,可快速有效的激活免疫系统,产生毒性CD8+T细胞,有高达普通疫苗180倍的抗体滴度。同时,在短期内,纳米疫苗可以在体内安全代谢,表现出良好的生物相容性。
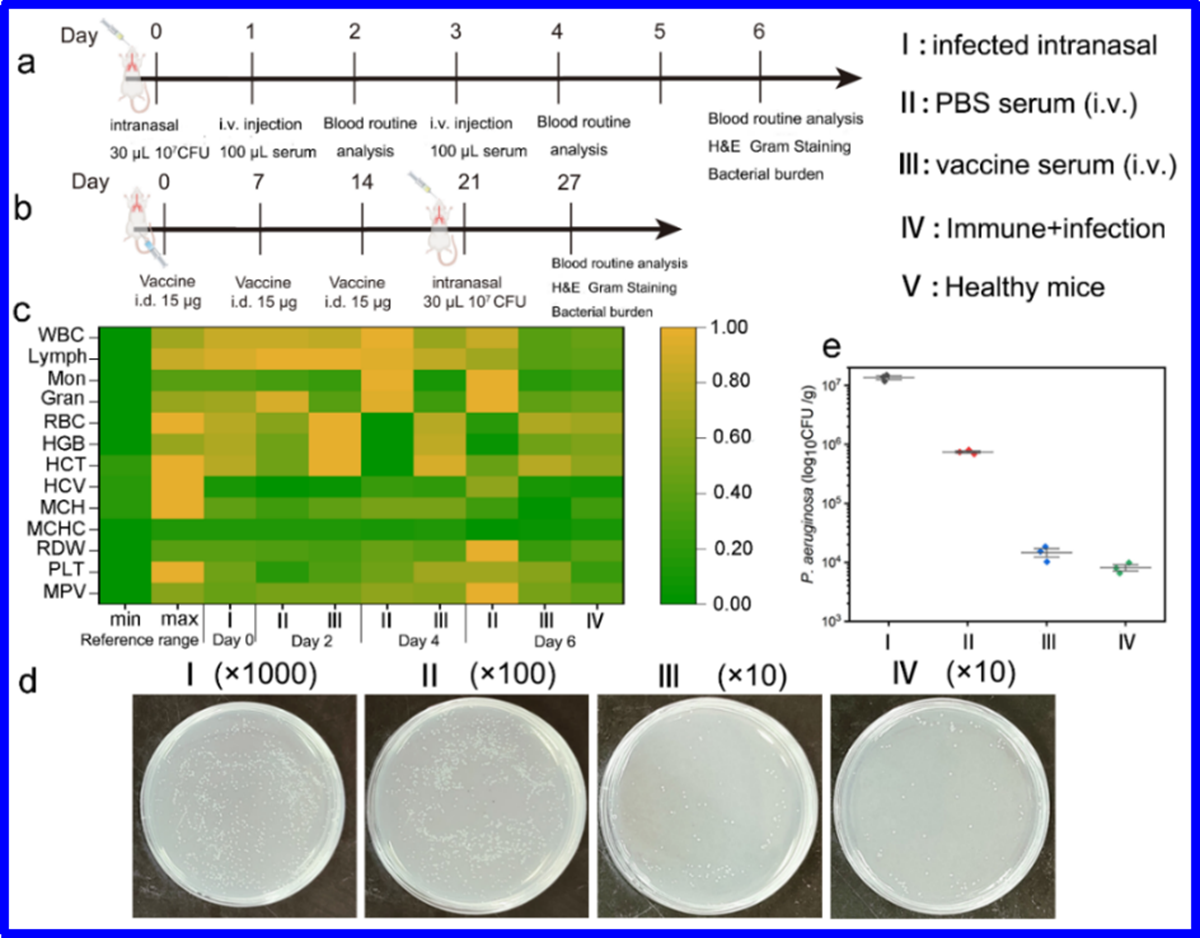
图3 治疗和预防效果评价
动物感染模型表明(图3a),免疫后小鼠的血清可以有效清除小鼠体内的细菌,降低了肺部的细菌负载量,使之达到正常水平。
我校博士生吴阳为论文第一作者,韩鹤友教授为通讯作者。本研究相关成果为解决肺部深层组织感染提供了治疗策略,同时为设计抗菌、抗病毒纳米疫苗提供了新思路。研究得到了“国家自然科学基金”(21778020)等项目的资助。
审核人:韩鹤友
【英文摘要】
The increase in drug-resistant microbial infections and the reduction in the number of approvals for new antibiotic categories make engineered biological agents difficult to use in traditional therapies. Here, we reported a nanovaccine encapsulated in the bacterial outer membrane vesicles (OMVs) to enhance the antibacterial immunotherapy of bacterial pneumonia. Using Pseudomonas aeruginosa as a model pathogen, we successfully synthesized the LPS@DMON@OMV nanovaccine using the non-replicable bacterial OMV as the antigen and LPS as the adjuvant. When injected subcutaneously, the vaccine induced rapid activation and maturation of dendritic cells (DCs) in the lymph nodes of immunized mice. The specific antibody titer stimulated by nanovaccine was 180 times higher than that stimulated by free OMV, and it can also stimulate the generation of more toxic T cells to eliminate bacteria in the body. In addition, the nanovaccine can also stimulate the body to form immune memory. The specific antibodies and memory T cells in the body can be retained for up to three months, which can prevent the risk of bacterial infection. These results indicate that the use of natural bacterial membranes to encapsulate synthetic nanoparticles has great prospects in the design of effective antibacterial vaccines.
