南湖新闻网讯(通讯员 莫陈汨)近日,我校植物科学技术学院植物线虫病害绿色防控团队从线虫生防真菌淡紫紫孢菌中鉴定了一个与真菌生长发育、抗逆和杀线虫活性相关的关键蛋白PlCYP5,为利用淡紫紫孢菌绿色防控植物线虫提供重要理论依据。
该研究首次在丝状真菌中报道了核糖体蛋白专用分子伴侣系统,解析了亲环蛋白PlCYP5作为核糖体蛋白专用分子伴侣调控核糖体生物形成的新机制。相关成果以“Cyclophilin acts as a ribosome biogenesis factor by chaperoning the ribosomal protein (PlRPS15) in filamentous fungi”为题在Nucleic Acids Research上在线发表。
目前已知植物病原线虫超过4100种,每年造成上千亿美元的经济损失,在我国仅蔬菜每年因根结线虫病造成的损失就超过30亿元。由于苯线磷、硫线磷、溴甲烷和涕灭威等化学杀线虫农药陆续被禁止或限制使用,线虫防治可选用的药剂越来越有限。淡紫紫孢菌是重要的植物线虫病生防真菌,可以寄生线虫卵,且其代谢产物能杀死线虫的幼虫和雌虫,田间施用该生防菌可显著减轻根结线虫、孢囊线虫和茎线虫等重要植物线虫病的危害。
据悉,肖炎农教授领衔的研究团队长期致力于线虫病害的绿色防控应用及其基础研究,对淡紫紫孢菌全基因组进行了测序,建立了淡紫紫孢菌与病原线虫互作体系,解析其生防机理,研制出了生防菌淡紫紫孢菌的颗粒制剂。该团队前期通过转录组结合基因家族分析,从淡紫紫孢菌亲环蛋白家族中鉴定到参与杀线虫活性和抵抗逆境的亲环蛋白PlCYP5。基因PlCYP5敲除突变体的生长、产孢和杀线虫能力均显著下降,同时对逆境胁迫更为敏感,为亲环蛋白应用于淡紫紫孢菌遗传改良奠定了理论基础。
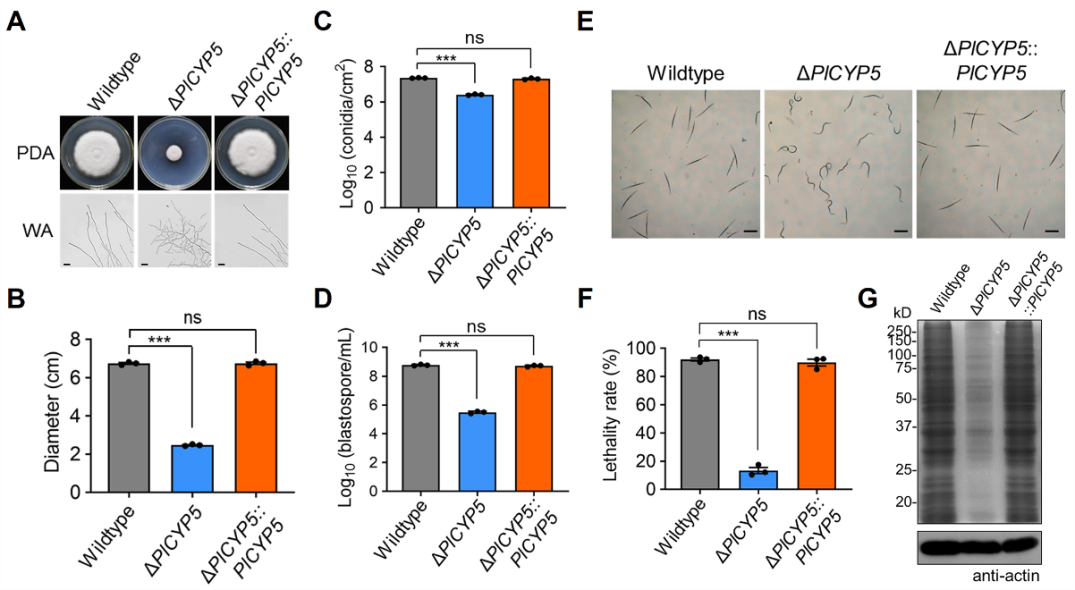
图1 PlCYP5突变体影响淡紫紫孢菌生长发育和杀线虫活性
转录组分析表明PlCYP5突变体差异表达基因主要富集于核糖体生物形成和核糖体RNA代谢途径,PlCYP5结合细胞质中游离的核糖体小亚基蛋白PlRPS15,维持PlRPS15蛋白稳定性并护送其到达细胞核中的核糖体组装位点。PlRPS15基因敲低突变体和PlCYP5突变体表现出一致的核糖体异常表型,解析了PlCYP5调控核糖体生物形成的机制,发现了PlCYP5作为核糖体蛋白专用分子伴侣的新功能。此外,与其他物种同源蛋白的交叉互作试验表明,PlCYP5-PlRPS15互作模式为丝状真菌特有,首次提出了丝状真菌中核糖体蛋白专用分子伴侣系统,丰富了对核糖体生物形成的认识,也为其他物种同源蛋白的功能研究提供了参考。
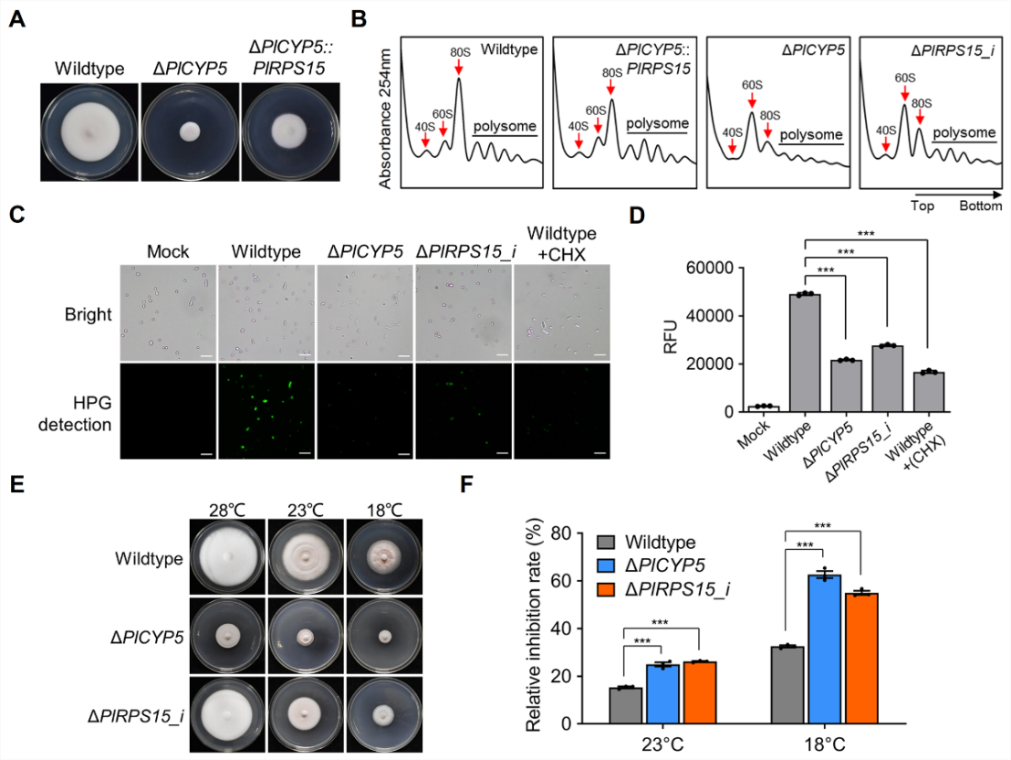
图2 PlCYP5与PlRPS15突变体均表现出核糖体功能异常
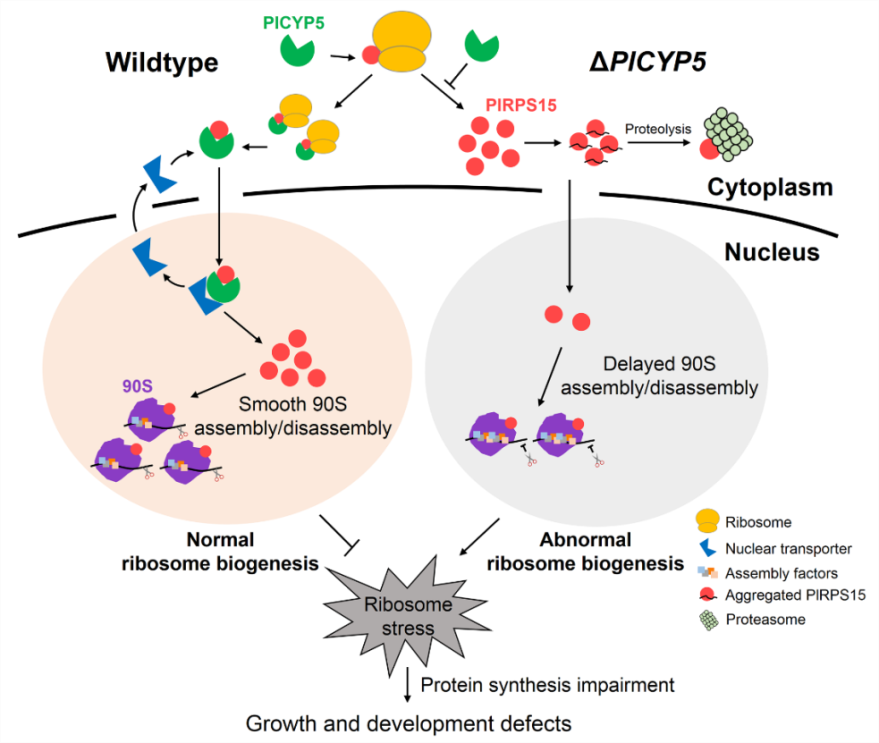
图3 PlCYP5-PlRPS15互作调控核糖体生物形成模式图
我校农业微生物学国家重点实验室、植物科学与技术学院博士研究生莫陈汨为论文第一作者,肖炎农教授和肖雪琼副教授为论文通讯作者,团队王高峰老师参与了研究工作。该研究得到国家自然科学基金、国家重点研发计划项目和中央高校基本科研业务费专项资金等项目资助。
审核人:肖雪琼
【英文摘要】
The rapid transport of ribosomal proteins (RPs) into the nucleus and their efficient assembly into pre-ribosomal particles are prerequisites for ribosome biogenesis. Proteins that act as dedicated chaperones for RPs to maintain their stability and facilitate their assembly have not been identified in filamentous fungi. PlCYP5 is a nuclear cyclophilin in the nematophagous fungus Purpureocillium lilacinum, whose expression is up-regulated during abiotic stress and nematode egg-parasitism. Here, we found that PlCYP5 co-translationally interacted with the unassembled small ribosomal subunit protein, PlRPS15 (uS19). PlRPS15 contained a eukaryote-specific N-terminal extension that mediated the interaction with PlCYP5. PlCYP5 increased the solubility of PlRPS15 independent of its catalytic peptide-prolyl isomerase function and supported the integration of PlRPS15 into pre-ribosomes. Consistently, the phenotypes of the PlCYP5 loss-of-function mutant were similar to those of the PlRPS15 knockdown mutant (e.g., growth and ribosome biogenesis defects). PlCYP5 homologs in Arabidopsis thaliana, Homo sapiens, Schizosaccharomyces pombe, Sclerotinia sclerotiorum, Botrytis cinerea, and Metarhizium anisopliae were identified. Notably, PlCYP5-PlRPS15 homologs from three filamentous fungi interacted with each other but not those from other species. In summary, our data disclosed a unique dedicated chaperone system for RPs by cyclophilin in filamentous fungi.
