南湖新闻网讯(通讯员:彭婷 )近日,生物医学与健康学院李姗教授团队在Nature 子刊《Communications Biology》杂志上在线发表了题为“Arginine GlcNAcylation of Rab small GTPases by the pathogen Salmonella Typhimurium”的研究成果。本研究对沙门氏菌三型分泌系统效应蛋白SseK3进行了全新的底物筛选以及功能研究,为特异性抑菌药物的研发提供了新靶点。
沙门氏菌是革兰氏阴性肠道病原菌,严重影响着人类的公共健康。沙门氏菌利用三型分泌系统 T3SS把效应蛋白直接注入到宿主细胞来操纵细胞内的生物学过程,从而维持细菌在宿主细胞内的稳定性,逃逸宿主细胞的免疫清除反应,促进感染发生。
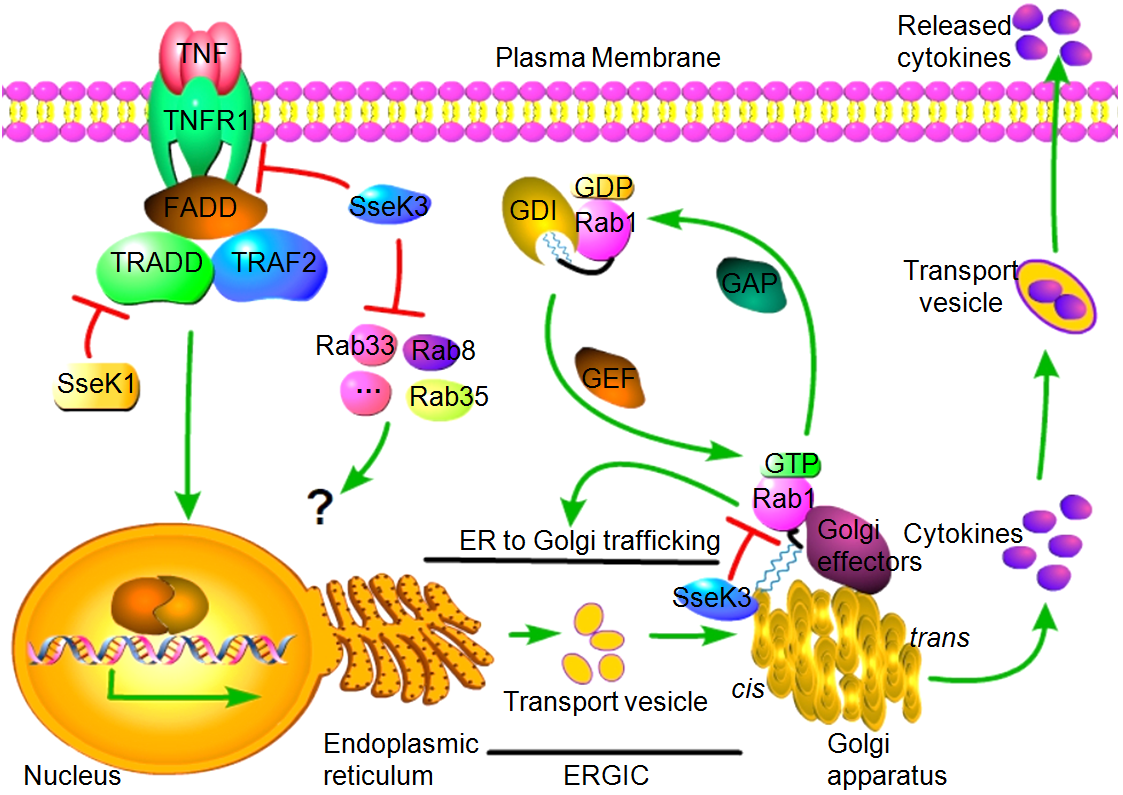
图片1
研究人员利用Suntag标记技术监测了沙门氏菌感染过程SseK3定位于顺式高尔基体的动态过程,发现SseK3的高尔基体定位部分依赖于PtdIns(4,5)P2;沙门氏菌感染不同类型的细胞系后,通过Arg-GlcNAc特异性抗体富集联合高分辨率质谱技术,挖掘到SseK3宿主中全新底物为Rab GTPase,其中SseK3对于Rab1的修饰程度最强;SseK3对于Rab1的修饰依赖于Rabs的C-末端异戊二烯化信号肽,而不依赖于GTP-或GDP结合形式;通过MS/MS分析发现Rab1存在4个精氨酸GlcNAcylation修饰位点(R72/R74/R82/R111);GlcNAcylation修饰严重干扰了Rab1的功能,阻断了Rab1与GDI蛋白的结合,打破了Rab1细胞质-细胞膜的循环平衡,抑制了宿主细胞内质网-高尔基体的运输过程;更重要的是,SseK3的精氨酸-GlcNAc转移酶活性对于沙门氏菌在RAW264.7巨噬细胞中复制和沙门氏菌感染小鼠模型中的细菌毒力至关重要。该研究发现了沙门氏菌作用于宿主细胞囊泡运输系统的一种新策略,为特异性抑菌药物的研发提供了新靶点。
李姗教授为本文的通讯作者,十堰市太和医院孟昆博士,华中农业大学硕士生庄晓慧和博士生彭婷为本文的共同第一作者。
论文链接:https://www.nature.com/articles/s42003-020-1005-2.
审核:李姗
